Revista Colombiana de
Tecnologías de Avanzada
Tecnologías de Avanzada
Recibido: 15 de enero de 2023
Aceptado: 15 de febrero de 2023
Aceptado: 15 de febrero de 2023
CARACTERIZACIÓN DE MEZCLAS DE MATERIALES POLIMÉRICOS NATURALES PARA ENCAPSULACIÓN, MEDIANTE SECADO POR ASPERSIÓN
CHARACTERIZATION OF MIXTURES OF NATURAL POLYMERIC MATERIALS FOR ENCAPSULATION, BY SPRAY DRYING
 MSc. Luz Alba Caballero Pérez*,
MSc. Luz Alba Caballero Pérez*,  PhD. Aldo Hernández Monzón**,
PhD. Aldo Hernández Monzón**,  PhD. Rene Tejedor Arias**,
PhD. Rene Tejedor Arias**,  MSc. Everaldo Joaquin Montes Montes***
MSc. Everaldo Joaquin Montes Montes***
* Universidad de Pamplona, Facultad de Ingenierías y Arquitecturas. Estudiante de Doctorado en Ciencia y Tecnología de los Alimentos. Universidad de la Habana, Cuba. Directora Grupo de Investigaciones GIBA.
Km 1 Vía Bucaramanga, Campus Universitario, Pamplona, Colombia.
Tel.: 057 5685303
E-mail: luzcaballero@unipamplona.edu.co
** Universidad de la Habana, Docentes Titulares. Instituto de Farmacia y Alimentos, IFAL. Programa Doctorado en Ciencias de los Alimentos, La Habana, Cuba.
E-mail: renetejedor09@yahoo.es
*** Universidad de Córdoba, Programa Ingeniería de Alimentos, Montería, Colombia.
E-mail: everaldomontes@yahoo.com
CHARACTERIZATION OF MIXTURES OF NATURAL POLYMERIC MATERIALS FOR ENCAPSULATION, BY SPRAY DRYING
 MSc. Luz Alba Caballero Pérez*,
MSc. Luz Alba Caballero Pérez*,  PhD. Aldo Hernández Monzón**,
PhD. Aldo Hernández Monzón**,  PhD. Rene Tejedor Arias**,
PhD. Rene Tejedor Arias**,  MSc. Everaldo Joaquin Montes Montes***
MSc. Everaldo Joaquin Montes Montes***
* Universidad de Pamplona, Facultad de Ingenierías y Arquitecturas. Estudiante de Doctorado en Ciencia y Tecnología de los Alimentos. Universidad de la Habana, Cuba. Directora Grupo de Investigaciones GIBA.
Km 1 Vía Bucaramanga, Campus Universitario, Pamplona, Colombia.
Tel.: 057 5685303
E-mail: luzcaballero@unipamplona.edu.co
** Universidad de la Habana, Docentes Titulares. Instituto de Farmacia y Alimentos, IFAL. Programa Doctorado en Ciencias de los Alimentos, La Habana, Cuba.
E-mail: renetejedor09@yahoo.es
*** Universidad de Córdoba, Programa Ingeniería de Alimentos, Montería, Colombia.
E-mail: everaldomontes@yahoo.com
Cómo citar: Caballero Pérez, L. A., Hernández Monzón, A., Tejedor Arias, R., & Montes Montes , E. J. (2023). CARACTERIZACIÓN DE MEZCLAS DE MATERIALES POLIMÉRICOS NATURALES PARA ENCAPSULACIÓN, MEDIANTE SECADO POR ASPERSIÓN. REVISTA COLOMBIANA DE TECNOLOGIAS DE AVANZADA (RCTA), 1(41), 1–11. https://doi.org/10.24054/rcta.v1i41.2412
Derechos de autor 2023 Revista Colombiana de Tecnologías de Avanzada (RCTA).
Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.

Resumen: Antecedentes: Las actuales tendencias están orientadas al uso de polímeros naturales como material encapsulante en la búsqueda de nuevas alternativas que mantengan la viabilidad de microorganismos a encapsular mediante el secado por aspersión. La caracterización de los materiales encapsulantes a emplear es muy importante para obtener resultados adecuados. Objetivos: El objetivo de esta investigación fue caracterizar una mezcla de polímeros naturales como material encapsulante de una mezcla de cultivos probióticos mediante uso de un equipo de secado por aspersión, marca© Vibrasec. Métodos: La parte experimental se realizó en las Instalaciones del Laboratorio de Ingenierías, Universidad de Córdoba, Montería Colombia. Se realizó la caracterización fisicoquímica del material encapsulante (almidón de yuca nativo, harina de avena y alginato de sodio): análisis granulométrico, temperatura vítrea, análisis a las suspensiones: pH, acidez, contenido de humedad, densidad aparente y viscosidad aparente, se evaluó la temperatura de gelatinización a diferentes concentraciones (3 ,5 y 7 %) y temperaturas (27, 60 y 90 °C) con el fin de determinar las temperaturas y concentraciones de sólidos adecuados del material encapsulante en mezcla para preparar las suspensiones que cumplan las restricciones del equipo de secado (700 mPas) © Vibrasec. Resultados: Los resultados indicaron que el alginato de sodio debe trabajarse máximo al 2 % de concentración de sólidos y una temperatura de 85 °C, mientras que la harina de avena (7 %) y el almidón de yuca nativo (10 %) deben trabajarse a una temperatura de 60 °C. En la preparación de las disoluciones de las mezclas del material encapsulante se estableció que la máxima concentración de las mezclas debía ser del 12 % para obtener una buena homogenización de las mezclas y una viscosidad (700 mPas) dentro de la restricción de uso del equipo de secado © Vibrasec. Conclusiones: Se logró caracterizar el material encapsulante conformado por harina de avena, alginato de sodio y almidón de yuca nativo estableciendo las condiciones adecuadas para ser sometidos al secado por aspersión en el equipo Marca © Vibrasec.
Palabras clave: alginato de sodio, almidón de yuca nativo, harina de avena, material encapsulante, secado por aspersión.
Abstract: Background: The characterization of the encapsulating materials to be used in the encapsulation is very important to obtain adequate results and maintain the characteristics of the materials to be encapsulated when subjected to spray drying. Objectives: The objective of this research was to characterize a mixture of natural polymers as an encapsulating material to be used in spray-drying equipment, © Vibrasec brand. Methods: The experimental part was carried out in the facilities of the Engineering Laboratory, University of Córdoba, Montería, Colombia. The physicochemical characterization of the encapsulating material (native cassava starch, oatmeal and sodium alginate) was carried out: granulometric analysis, glass temperature, suspension analysis: pH, acidity, moisture content, apparent density and apparent viscosity, was evaluated. the gelatinization temperature at different concentrations (3.5 and 7%) and temperatures (27, 60 and 90 °C) in order to determine the appropriate temperatures and solid concentrations of the encapsulating material in mixture to prepare the suspensions that meet the drying equipment restrictions (700 mPas) © Vibrasec. Results: The results indicated that sodium alginate should be worked at a maximum of 2% solids concentration and a temperature of 85 °C, while oatmeal (7%) and native cassava starch (10%) should be worked at a temperature of 60°C. In the preparation of the solutions of the mixtures of the encapsulating material, it was established that the maximum concentration of the mixtures should be 12% to obtain a good homogenization of the mixtures and a viscosity (700 mPas) within the restriction of use of the equipment. drying © Vibrasec. Conclusions: It was possible to characterize the encapsulating material made up of oatmeal, sodium alginate and native cassava starch, establishing the appropriate conditions to be subjected to spray drying in the Marca © Vibrasec equipment.
Keywords: sodium alginate, native cassava starch, oatmeal, encapsulating material, spray drying.
El secado por aspersión es el método más común de encapsulación de ingredientes alimenticios, por ser más económico comparado con otras técnicas (Arslan, et al., 2015; Eckert, C. et al., 2017), así como por la disponibilidad de equipamientos, buena estabilidad del producto final (Gul, 2017; Ceja-Medina et al., 2020); Esta técnica se puede aplicar a materiales hidrosolubles, aceites de pescado (DHA y EPA), pigmentos naturales, concentrado de células probióticas y leche en polvo (Ceja-Medina, et at., 2021; Sun, et al., 2023). En el secado por aspersión la elección de los agentes encapsulantes o material de cobertura es crítica, ya que pueden intervenir en las propiedades de la emulsión antes del secado, tamaño de partícula y propiedades de flujo, así como en la retención de compuestos volátiles durante el proceso y en la vida útil del polvo después del secado.
Un factor de gran importancia son los agentes encapsulantes utilizados, dentro de los cuales podemos encontrar diferentes tipos como: los lípidos: grasa láctea, lecitinas, ceras, ácido esteárico, monoglicéridos, diglicéridos, aceites hidrogenados; son excelentes formadores de películas capaces de cubrir las partículas individuales, proporcionando una encapsulación uniforme. Los hidratos de carbono son ampliamente utilizados, principalmente con la técnica de secado por aspersión como soporte de encapsulamiento, dentro de este grupo se encuentran los almidones, maltodextrinas y gomas. Hoy día se está estudiando el uso de matrices micro encapsulantes poliméricas provenientes de polisacáridos y sus posibles combinaciones que permitan la correcta conservación de la capa encapsulante y del material activo a encapsular. (Nie, 2013; Esquivel‐González, et al., 2015; Fritzen-Freire, et al., 2021; Madsen, et al., 2022; Mikkel et al., 2022).
El material protector debe reunir ciertas propiedades que dependen de las características químicas del material encapsulado, la aplicación, las condiciones de almacenamiento y del proceso expuesto por (Nag, 2011; Moumita, et al., 2017; Homayouni-Rad et al., 2021). El primer paso en la encapsulación es la selección de una matriz de encapsulación adecuada (Rios-Aguirre, y Gil-Garzon, 2021; Tamtürk, et al., 2023). Las investigaciones en torno a este tema, se centran en la búsqueda y aplicación de nuevos materiales de recubrimiento y técnicas novedosas de encapsulación. (Ávila-Reyes, 2014; Ceja-Medina, et al., 2021; Barros, et al., 2022).
En esta investigación, se evaluaron tres materiales los cuales se escogieron por poseer propiedades encapsulantes y prebióticas para someterlos al secado por aspersión en un equipo marca© Vibrasec. El almidón de yuca nativo (Manihot sculenta Crantz) y el alginato de sodio han sido investigados por su habilidad de ser utilizados como material de pared para la encapsulación, tienen amplia distribución de tamaño (Aristizábal, y Sánchez, 2007; Lupo-Pasin et al., 2012; Etchepare, et al., 2016). En la encapsulación de probióticos, se usa en concentraciones moderadas sin embargo presenta poca resistencia a los ácidos gástricos, esta característica puede ser contrarrestada al modificar la estructura del gel, al emplear sistemas mixtos poliméricos para la formación de la matriz o con el recubrimiento de las macropartículas (Lupo-Pasin et al., 2012; El-Sayed, et al., 2017; Tao, T., et al., 2019; Triviño, 2019).
La harina de avena contiene almidones, β - α Glucanos y pequeñas cantidades de proteínas que lo hacen un material prebiótico con la posibilidad de formar películas fuertes, resistentes y flexibles para mejorar las propiedades del alginato y el almidón de yuca nativo (Ta, et al., 2021). El beta-glucano de la avena puede llevar a la declaración de salud aprobada por la FDA (Yonekura, et al., 2014; Yuan, et al., 2023 17). Diversos estudios han publicado algunas características fisicoquímicas y reológicas de los principales componentes de la avena, destacándose los trabajos realizados por (Berski, et al., 2011; Zamora-Vega, et al., 2012; Zamudio-Flores, et al., 2015; Flores-Peña, et al., 2013).
Las investigaciones en torno a este tema se centran en la búsqueda y aplicación de nuevos materiales de recubrimiento para someterlos al secado por aspersión. Por lo que en esta investigación se planteó evaluar las características fisicoquímicas (contenido de sólidos y temperatura de gelatinización) de una mezcla de materiales poliméricos naturales con características prebióticas para encapsular una mezcla de microorganismos mediante la técnica de secado por aspersión, para definir la concentración adecuada cumpliendo las restricciones de viscosidad del equipo © Vibrasec.
Como agentes encapsulantes se utilizaron: Almidón de yuca nativo, (INNOVAYUCA), Alginato de sodio (SQ 942) y Harina de avena molida.
Una vez se estableció la concentración de sólidos y temperatura vítrea (Tg) de los tres materiales encapsulantes, se realizaron ensayos para definir la máxima concentración de sólidos a trabajar por material de manera individual y con la mezcla de los materiales en suspensión: pruebas de calentamiento a diferentes concentraciones de sólidos frente a la viscosidad aparente y cumplir la restricción en la viscosidad exigida para el uso del equipo © Vibrasec, técnica empleada por (Nielsen, 2010; Aristizábal, y Sánchez, 2007).
Los resultados del análisis granulométrico de los materiales encapsulantes, evidencian diferencias en el tamaño de partícula entre la harina de avena y el almidón de yuca nativo (Manihot sculenta Crantz), de fina a muy fina, aspecto que se tuvo en cuenta para el proceso de mezclado, estableciendo que en la preparación de la matriz encapsulante debía efectuarse en forma húmeda (disolución) para evitar que ocurriera el fenómeno de disgregación, lo que dificultaría el mezclado, en atención a lo expuesto por (Esquivel‐González, et al., 2015) quienes establecieron que un mayor número de poros permiten mayor hidratación de la partícula y una superficie disponible facilita la unión de cationes; de ahí radica la importancia de una granulometría fina en los materiales encapsulantes a emplear.
Valores medios informados corresponden a 3 determinaciones
Como se observa en la Tabla 2 los materiales encapsulantes presentaron pH, densidad aparente y contenido de humedad dentro de los intervalos de las normas (García-Ceja, y López-Malo, 2012; Madsen, et al., 2022) siendo adecuados para formar cápsulas de diferentes tamaños a causa de las interacciones moleculares de los diferentes materiales poliméricos a combinar (Barbosa-Cánovas, 2005; Lupo-Pasin, et al., 2012; Arslan, S., Erbas, M., Tontul, I., Y Topuz, 2015).
Los resultados de calorimetría (DSC) permitieron evaluar si los materiales encapsulantes a trabajar presentaban incompatibilidad dentro de las formulaciones tanto de los componentes individuales como en mezcla. Como se observa en la tabla 3 la temperatura vítrea de los tres materiales se encuentra en un rango 62 -85 °C de temperatura de transición vítrea (Tg) lo que favorece obtener adecuadas condiciones para las disoluciones al momento de realizar las diferentes mezclas (Perdomo, et al., 2009; Ceja-Medina, et al., 2020). Este resultado indica que la temperatura de alimentación de los materiales encapsulantes debe trabajarse a temperaturas inferiores a 63 oC, para el caso del almidón de yuca nativo (Manihot sculenta Crantz) y la harina de avena pudiera ser 60 oC para facilitar su solubilización sin que gelatinice (Richardson, et al., 2000), mientras que el alginato de sodio debe trabajarse a una temperatura menor a los 85 °C, por lo que se deben preparar por seprarado antes de mezclarse.
En la tabla 4 se presenta los resultados del análisis de comparaciones multiples Tukey de los valores promedios.
La viscosidad aparente con mayor promedio se presentó con el alginato de sodio (Nielsen, 2010; Holkem, et al., 2016), seguidamente con el almidón de yuca nativo y la harina de avena siendo este último el que menos viscosidad presento en las temperaturas y concentraciones evaluadas. Así mismo la viscosidad aparente promedio varía en los tres materiales según la concentración de sólidos. A las concentraciones de 7% y 5% se produce una viscosidad estadísticamente muy parecida entre la harina de avena y el almidón de yuca nativo (Karimi, et al., 2023), (ver tabla 4).
De otra parte, la viscosidad aparente en los tres materiales varía según la temperatura de calentamiento, observando que la harina de avena y el almidón de yuca presentaron una viscosidad similar a temperaturas entre 50 y 60 °C mientras el alginato de sodio presento los valores más altos de viscosidad a medida que aumentaba la temperatura y la concentración de sólidos, igualmente se observa que a la temperatura de 60 °C se presenta la viscosidad promedio más alta. (De Araujo, et al., 2016).
La Tabla 5 muestra los resultados de la viscosidad de las disoluciones de alginato de sodio a temperaturas de 60 y 96 °C, teniendo en cuenta la capacidad de absorción de agua a diferentes concentraciones de sólidos de 2 y 3 % (p/v) dado que el valor máximo reportado para su uso como material encapsulante de probióticos ha sido de 5 % (Rios-Aguirre, et al., 2021).
Resultados que corroboran lo expuesto por (Perdomo, et al., 2009; Wan et al., 2010; Mikkel., et al., 2022) la viscosidad de las soluciones de alginato depende de la concentración, a partir del 2 % la viscosidad de la solución aumenta considerablemente y tiene un comportamiento no newtoniano, su viscosidad no es constante.
En la Tabla 6 se presentan los resultados de viscosidad aparente de las disoluciones de almidón de yuca nativo y la harina de avena a concentraciones de 3, 5 y 7 % a una temperatura de 60 °C.
Estos resultados coinciden con los reportados por (Dikeman, y Fahey. 2006; Lazaridou, y Biliaderis, 2007; Regand, et al., 2011; Rodríguez‐Restrepo, et al., 2017; Zamudio-Flores, et al., 2021), quienes indican que los incrementos en los valores de viscosidad aparente entre las dispersiones están directamente asociados al mayor contenido de fibra en las concentraciones mayores debido a la presencia de -glucanos en la harina de avena.
La Tabla 7 muestra la viscosidad aparente de las mezclas de materiales encapsulantes en suspensión a la temperatura de trabajo definida (60 ° C) a diferente concentración de sólidos.
En la Tabla 8 se puede apreciar el comportamiento de las mezclas de los materiales encapsulantes sometidas al secado por aspersión en el equipo Vibrasec.
A partir de estos resultados, las mezclas del material encapsulante fueron sometidas al proceso de secado por aspersión a una temperatura de alimentación de 60 °C, a temperaturas de entrada de aire de 200 °C, como se observa en la tabla 8 las concentraciones de sólidos de 14 y 16 % presentaron saturación en la cámara y una humedad entre 8.68 y 9.23 %, resultados que concuerdan con lo expuesto por (Rios-Aguirre, et al., 2021; Salinas, et al., 2021; Tamtürk, et al., 2023), quienes indican que la temperatura de aire de entrada es directamente proporcional a la velocidad de secado de las microcápsulas y al contenido de agua final, ya que al tener mayor humedad adsorbida, las fuerzas de cohesión entre partículas tenderán a ser mayores, es decir, que van a haber mayores puentes de contacto entre ellas lo cual, puede afectar indirectamente la velocidad de dispersión de los materiales encapsulantes reflejado en la saturación de la cámara de secado. Mientras que las concentraciones de 10 y 12 % de sólidos tuvo un comportamiento normal en la cámara y una humedad entre 4.58 y 4.32 %.
Este resultado permitió seleccionar la concentración del 12 % de sólidos como la más apropiada de las mezclas del material encapsulante en suspensión a emplear en el secado por aspersión bajo las condiciones evaluadas del equipo © Vibrasec, descartando la concentración del 10 % por considerar muy bajo el contenido de sólidos (Soto, et al., 2023; Tamtürk, et al., 2023).
A.O.A.C. 965.22. (1995). Official Methods of Analysis. Association of Official Analytical Chemist. EUA. Análisis granulometrico para harinas.
A.O.A.C. 981.12. (2012). Official Methods of Analysis. Association of Official Analytical Chemist. EUA. pH.
AOAC. (942.15, 2005). Official Methods of Analysis. Association of Official Analytical Chemist. EUA. Acidez.
Aristizábal, J., y Sánchez, T. (2007). Guía técnica para producción y análisis de almidón de yuca. Boletín de servicios agrícolas de la FAO 163. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma, Pp. 153.
Arslan, S., Erbas, M., Tontul, I., Y Topuz, A. (2015). Microencapsulation of probiotic Saccharomyces cerevisiae var. boulardii with different wall materials by spray drying. LWT-Food Science and Technology, 63(1), 685-690.
Ávila-Reyes, S. V, y otros cuatro autores, (2014). Protection of L. rhamnosus by spray-drying using two prebiotics colloids to enhance the viability, doi:https://doi.org/10.1016/j.carbpol.2013.11.033, Carbohydrate Polymers, 102, 423 -432.
Barbosa-Cánovas, G. V. (2005). Compression and Compaction Characteristics of Selected Food Powders. En Advances in Food and Nutrition doi:10.1016/S1043-4526. Research. Academic Press, Vol. 49 , págs. 233-307.
Barros, Cp, Silva, R., Guimarães, Jt, Balhtazar, Cf, Verruck, S., Pimentel, Tc, ... & Da Cruz, Ag (2022). Prebióticos y simbióticos en alimentos funcionales. https://doi.org/10.1002/9781119776345.ch2. Alimentos funcionales, 21-53.
Berski, W., A. Ptaszek, P. Ptaszek, R. Ziobro, G. Kowalski, M. Grzesik and B. Achremowicz. (2011). Pasting and rheological properties of oat starch and its derivatives. https://doi.org/10.1016/j.carbpol.2010.08.036. Carbohydrate Polymers 83.: 665-671.
Ceja-Medina, L. I., L. y otros siete autores, (2021). In vitro synbiotic activity of Lactobacillus plantarum encapsulated with mixtures of Aloe vera mucilage, agave fructans and food additives as wall materials, https://doi.org/10.24275/rmiq/Bio2234, Revista Mexicana de Ingeniería Química, ISSN-E: 2395-8472, ISSN:1665-2738, 20 (2): 711–723.
Ceja-Medina, L. I., R. I. Ortiz-Basurto, L. Medina-Torres, F. Calderas, M. J. Bernad-Bernad, R. F. González-Laredo, J. A. Ragazzo-Sánchez, M. Calderón-Santoyo, M. González-Ávila, I. Andradegonzález & O. Manero. (2020). Microencapsulation of Lactobacillus plantarum by spray drying with mixtures of Aloe vera mucilage and agave fructans as wall materials. https://doi.org/10.1111/jfpe.1343. Journal of Food Process Engineering. 43(8): e13436.
CODEX STAN 176. (1989). Norma del Codex Para la Harina de Yuca Comestible.
De Araujo, Scratch Etchepare, M., Raddatz, GC, Cichoski, AJ, Flores, É.M M , Barin , JS , Zepka , LQ , ... & de Menezes , C R. (2016). Efecto del almidón resistente (Hi-maize) sobre la supervivencia de Lactobacillus acidophilus microencapsulado con alginato de sodio. Revista de Alimentos Funcionales, 21, 321–329.
Dikeman, C. L. and G. C. Fahey. (2006). Viscosity as related to dietary fiber: A review. Critical https://doi.org/10.1080/10408390500511862. Reviews in Food Science Nutrition 46 (8):649-663.
Eckert, C. y otros siete autores, (2017). Microencapsulation of Lactobacillus plantarum ATCC 8014 through spray drying and using dairy whey as wall materials, https://doi.org/10.1016/j.lwt.2017.04.045, LWT Food Sci. Technol. 82, 176–183.
El-Sayed, H. S., Kassem, J. M., El-Shafei, K. A. W. T. H. E. R., Assem, F. M., & Sharaf, O. M. (2017). Comparative evaluation of the microencapsulation methods efficiency to protect probiotic strains in simulated gastric conditions. International Journal of Biology, Pharmacy and Allied Science, ISSN: 2277–4998, 6(3), 521-545.
Esquivel‐González, B., Ochoa Martínez, L., y Rutiaga-Quiñones, O. (2015). Microencapsulación mediante secado por aspersión de compuestos bioactivos. https://www.redalyc.org/pdf/813/81343176006.pdf. Revista Iberoamericana de Tecnología Postcosecha, 16(2), 180-192.
Etchepare, M., Raddatz, G. C., Cichoski, A. J., Flores, E. M., Barin, J. S., Queiroz, Z. L., y de Menezes, C. R. (2016). Effect of resistant starch (Himaize) on the survival of Lactobacillus acidophillus microencapsulated with sodium alginate. doi:DOI: 10.1016/jff2015.12025. Journal of Functional Foods, 21, 321-329.
Flores-Peña, F. F.; Lozano-Quezada, F.Y.; Ramos-Martínez, A.; Salgado-Delgado, R.; Guerrero-Prieto, V. M.; Ramírez-Mancinas, S.; Bello-Pérez, L. A.; y Zamudio-Flores, P. B. (2013). Caracterización fisicoquímica, reológica y funcional de harina de avena (Avena sativa L. cv Bachíniva) cultivada en la región de Cuauhtémoc, Chihuahua. DOI: https://doi.org/10.54167/tch.v8i3.611. Revista Tecnociencia. Chihuahua. Vol. VIII, Núm. 3.
Fritzen-Freire, C. B. et al., (2021). Microencapsulation of bifidobacteria by spray drying in the presence of prebiotics. Available from: Accessed: Nov. 18, doi: 10.1016/j.foodres.2011.09.020, Food Research International, v. 45, p. 306-312.
Fuchs, M., Turchiuli, C., Bohin, M., Cuvelier, M., Ordonnaud, C., Peyrat-Maillard, M., y Dumoulin, E. (2006). Encapsulation of oil in poder using spray drying and fluidized bed agglomeration. https://doi.org/10.1016/j.jfoodeng.2005.03.047. Journal of Food Engineering, 75(1), 27 -35.
Gandomi, H., y otros cuatros autores, (2016). Effect of chitosan-alginate encapsulation with inulin on survival of Lactobacillus rhamnosus GG during apple juice storage and under simulated gastrointestinal conditions, https://doi.org/10.1016/j.lwt.2016.01.064.LWT-Food Science and Technology, 69, 365-371.
García, A., & López, A. (2012). Biopolímeros utilizados en la encapsulación. 6 (1). 84-97. Departamento de Ingeniería Química, Alimentos y Ambiental, Puebla, Recuperado de: https://www. udlap. mx/wp/tsia/files/No6, 1.
Goula, A. M., y Adamopoulos, K. G. (2012). A method for pomegranate seed application in food industries: Seed oil encapsulation,. Food and Bioproducts Processing, 90 (4), 639-652. doi:https://doi.org/10.1016/j.fbp.2012.06.001.
Holkem, At, Raddatz, Gc, Nunes, Gl, Cichoski, Aj, Jacob-Lopes, E., Grosso, Crf Y De Menezes, Cr (2016). Desarrollo y caracterización de microcápsulas de alginato que contienen Bifidobacterium BB-12 producidas por emulsificación/gelificación interna seguida de liofilización. https://doi.org/10.1016/j.lwt.2016.04.012. LWT-Ciencia y tecnología de los alimentos,71, 302-308.
Homayouni-Rad, y otros cuatro autores, (2021). Effect of Alyssum homolocarpum mucilage and inulin microencapsulation on the survivability of Lactobacillus casei in simulated gastrointestinal and high - temperature conditions, https://doi.org/10.1016/j.bcab.2021.102075., Biocatalysis and Agricultural Biotechnology 35: 102075.
Karimi, R., y otros cuatro autores, (2023). Interaction between β-glucans and gut microbiota: a comprehensive review, https://doi.org/10.1080/10408398.2023.2192281, Critical Reviews in Food Science and Nutrition, 1-32.
Lazaridou, A., & Biliaderis, C. G. (2007). Molecular aspects of cereal β-glucan functionality: Physical properties, technological applications and physiological effects. https://doi.org/10.1016/j.jcs.2007.05.003.Journal of cereal science, 46(2), 101-118.
Lupo-Pasin B, González A. C., Maestro G. A. (2012). Microencapsulación con alginato en alimentos. Técnicas y aplicaciones. Revista Venezolana de Ciencia y Tecnología de Alimentos., 3 (1):(2218-4384), 130-151.
Madsen, M., y otros cuatro autores, Simulated gastrointestinal digestion of protein alginate complexes: effects of whey protein cross-linking and the composition and degradation of alginate. https://doi.org/10.1039/D2FO01256A, Food & Function, 13(16), 8375-8387, (2022).
Mikkel Madsen, Mette E. Rønne, Ruifen Li, Ines Greco, Richard Ipsen y Birte Svensson. (2022). Digestión gastrointestinal simulada de complejos de proteína de alginato: efectos del entrecruzamiento de la proteína de suero y la composición y degradación del alginatohttps://doi.org/10.1039/D2FO01256A. This journal is © The Royal Society of Chemistry. Food Funct. volumen13, Pp 8375-8387. N° 16.
Moumita, S. et al., (2017). Evaluation of the viability of free and encapsulated lactic acid bacteria using in-vitro gastro intestinal model and survivability studies of symbiotic microcapsules in dry food matrix during storage. Doi: 10.1016/j.lwt.2016.11.079. LWT- Food Science and Technology, v. 77, p. 40-477.
Nag, A. (2011). Development of microencapsulation technique for probiotic bacteria Lactobacillus casei 431 using a protein polysaccharide complex. New Zealand: Massey University. http://hdl.handle.net/10179/2355.
Nie, S. P., Wang, C., Cui, S. W., Wang, Q., Xie, M. Y., & Phillips, G. O. (2013). A further amendment to the classical core structure of gum Arabic (Acacia senegal). https://doi.org/10.1016/j.foodhyd.2012.09.014. Food Hydrocolloids, 31(1), 42e48.
Nielsen, S. (2010). Viscosity Measurement Using a Brookfield Viscometer. Chapter 20. DOI: 10.1007/978-1-4419-1463-7_20. Food analysis laboratory manual (2), 167 – 168.
Nunes, G. L. et al., (2017). Inulin, hi-maize, and trehalose as thermal protectants for increasing viability of Lactobacillus acidophilus encapsulated by spray drying. Doi: 10.1016/j.lwt.2017.10.032. LWT- Food Science and Technology, v. 89, p. 128-133.
Paredes-López, O., Bello-Pérez, L. A., y López, M. G. (1994). Amylopectin: Structural, gelatinisation and retrogradation studies. Obtenido de https://doi.org/10.1016/0308-8146(94)90215-1. Food Chemistry, 50(4), 411-417.
Perdomo, J., Cova, A., Sandoval, A., García, L., Laredo, E., y Müller, A. (2009). Glass transition temperature and water sorption isotherms of cassava starch. https://doi.org/10.1016/j.carbpol.2008.10.023. Carbohydrate Polymers, 76, 305–310.
Regand, A., Z. Chowdhury, S. M. Tosh, T. M. S. Wolever and P. Wood. (2011). The molecular weight, solubility and viscosity of oat beta-glucan affect human glycemic response by modifying starch digestibility. https://doi.org/10.1016/j.foodchem.2011.04.053. Food Chemistry 129 : 297-304.
Rios-Aguirre, Sara y Gil-Garzon, Maritza Andrea. (2021). Microencapsulación por secado por aspersión de compuestos bioactivos en diversas matrices: una revisión. https://doi.org/10.22430/22565337.1836. TecnoL.[online]. vol.24, n.51, pp.206-229. ISSN 0123-7799.
Rodríguez, Y.A., Rojas, A.F., Rodríguez-Barona, S. (2016). Encapsulación de probióticos para aplicaciones alimenticias. Doi: 10.17151/biosa.2016.15.2.10. Revista Biosalud; 15(2): 106-115.
Rodríguez‐Restrepo, Y. A., Giraldo, G. I., & Rodríguez‐Barona, S. (2017). Solubility as a fundamental variable in the characterization of wall material by spray drying of food components: application to microencapsulation of Bifidobacterium animalis subsp. lactis. https://doi.org/10.1111/jfpe.12557. Journal of Food Process Engineering, 40(6), e12557.
Salinas, R. R., Loaiciga, V. Z., & Jaramillo, S. H. (2021). Probióticos: desafíos, revisión y alcance. https://doi.org/10.31434/rms.v6i6.686. Revista Médica Sinergia, 6 (6), e686-e686.
Soto, J. G. M., y otros cinco autores, (2023). Recent developments on wall materials for the microencapsulation of probiotics: A review, DOI: https://doi.org/10.54167/tch.v17i1.1140. Tecnociencia Chihuahua, 17(1), e1140-e1140.
Sun, Weizhe, Quang D. Nguyen, Botond Kálmán Süli, Firas Alarawi, Anett Szécsi, Vijai Kumar Gupta, László Ferenc Friedrich, Attila Gere, And Erika Bujna. (2023). Microencapsulación y Aplicación de Bacteria Probiótica Lactiplantibacillus plantarum 299v Cepa. Microorganismos, 11 (4), 947. https://doi.org/10.3390/microorganisms11040947.
Ta, L. P., y otros seis autores, (2021). Effects of various polysaccharides (alginate, carrageenan, gums, chitosan) and their combination with prebiotic saccharides (resistant starch, lactosucrose, lactulose) on the encapsulation of probiotic bacteria Lactobacillus casei 01 strain. International, https://doi.org/10.1016/j.ijbiomac.2021.04.170, Journal of Biological Macromolecules, 183, 1136-1144.
Tamtürk, F., Gürbüz, B., Toker, Ö. S., Dalabasmaz, S., Malakjani, N., Durmaz, Y., & Konar, N. (2023). Optimization of Chlorella vulgaris spray drying using various innovative wall materials. https://doi.org/10.1016/j.algal.2023.103115. Algal Research, 72, 103115.
Tao, T., y otros nueve autores, (2019). Influence of polysaccharide as co-encapsulant on powder characteristics, survival and viability of microencapsulated Lactobacillus paracasei Lpc-37 by spray drying, https://doi.org/10.1016/j.jfoodeng.2019.02.009, J. Food Eng, 252, 10–17.
Triviño Valencia, J. (2019). Efecto almacenamiento y las condiciones de estrés sobre la viabilidad de bifidobacterium animalis microencapsulado e incorporado en harina instantánea fortificada a base de plátano dominico hartón (Musa Aabsimmonds). Tesis (Magister en Microbiología Agroindustrial). Universidad Católica de Manizales. Instituto de Investigación en Microbiología y Biotecnología Agroindustrial. https://repositorio.ucm.edu.co/handle/10839/2532.
Wang., Q., Hu, X., Du, Y., y Kennedy, J. F. (2010). Alginate/starch blend fi bers and their properties for drug controlledrelease. https://doi.org/10.1016/j.carbpol.2010.06.004. Carbohydrate Polymers, 82(3), 842-847.
Yonekura, L., Sun, H., Soukoulis, C., Fisk, I. (2014). Microencapsulation of Lactobacillus acidophilus NCIMB 701748 in matrices containing soluble fibre by spray drying: Technological characterization, storage stability and survival after in vitro digestión. https://doi.org/10.1016/j.jff.2013.10.008. Journal of Functional Foods, 6, 205–214.
Yuan, C., y otros cuatro autores, (2023). Extraction and prebiotic potential of β-glucan from highland barley and its application in probiotic microcapsules, https://doi.org/10.1016/j.foodhyd., Food Hydrocolloids, 139, 108520.
Zamora-Vega, R., y otros seis autores, (2012), effect of incorporating prebiotics in coating materials for the microencapsulation of Sacharomyces boulardii.https://doi.org/10.3109/09637486.2012.687364. International journal of food sciences and nutrition, 63(8), 930-935.
Zamudio-Flores, P.B. et al. (2015), Digestibilidad in vitro y propiedades térmicas, morfológicas y funcionales de harinas y almidones de avenas de diferentes variedades. Rev. Mex. Ing. Quím [online]. vol.14, n.1 [citado 2023-06-06], pp.81-97. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1665-27382015000100008&lng=es&nrm=iso. ISSN 1665-2738.
Palabras clave: alginato de sodio, almidón de yuca nativo, harina de avena, material encapsulante, secado por aspersión.
Abstract: Background: The characterization of the encapsulating materials to be used in the encapsulation is very important to obtain adequate results and maintain the characteristics of the materials to be encapsulated when subjected to spray drying. Objectives: The objective of this research was to characterize a mixture of natural polymers as an encapsulating material to be used in spray-drying equipment, © Vibrasec brand. Methods: The experimental part was carried out in the facilities of the Engineering Laboratory, University of Córdoba, Montería, Colombia. The physicochemical characterization of the encapsulating material (native cassava starch, oatmeal and sodium alginate) was carried out: granulometric analysis, glass temperature, suspension analysis: pH, acidity, moisture content, apparent density and apparent viscosity, was evaluated. the gelatinization temperature at different concentrations (3.5 and 7%) and temperatures (27, 60 and 90 °C) in order to determine the appropriate temperatures and solid concentrations of the encapsulating material in mixture to prepare the suspensions that meet the drying equipment restrictions (700 mPas) © Vibrasec. Results: The results indicated that sodium alginate should be worked at a maximum of 2% solids concentration and a temperature of 85 °C, while oatmeal (7%) and native cassava starch (10%) should be worked at a temperature of 60°C. In the preparation of the solutions of the mixtures of the encapsulating material, it was established that the maximum concentration of the mixtures should be 12% to obtain a good homogenization of the mixtures and a viscosity (700 mPas) within the restriction of use of the equipment. drying © Vibrasec. Conclusions: It was possible to characterize the encapsulating material made up of oatmeal, sodium alginate and native cassava starch, establishing the appropriate conditions to be subjected to spray drying in the Marca © Vibrasec equipment.
Keywords: sodium alginate, native cassava starch, oatmeal, encapsulating material, spray drying.
1. INTRODUCCIÓN
La encapsulación es una técnica por la cual gotas líquidas, partículas sólidas o gaseosas, son cubiertas con una película polimérica porosa. Esta membrana, barrera o película está generalmente hecha de componentes con cadenas para crear una red polimérica (Fuchs et al., 2006). La estructura formada por el agente encapsulante alrededor de la sustancia encapsulada (núcleo) es llamada pared; esta protege el núcleo contra el deterioro y ayuda a la liberación bajo condiciones deseadas (Fuchs et al., 2006, Rodríguez, et al., 2016; Gandomi, et al., 2016; Nunes, et al., 2017).El secado por aspersión es el método más común de encapsulación de ingredientes alimenticios, por ser más económico comparado con otras técnicas (Arslan, et al., 2015; Eckert, C. et al., 2017), así como por la disponibilidad de equipamientos, buena estabilidad del producto final (Gul, 2017; Ceja-Medina et al., 2020); Esta técnica se puede aplicar a materiales hidrosolubles, aceites de pescado (DHA y EPA), pigmentos naturales, concentrado de células probióticas y leche en polvo (Ceja-Medina, et at., 2021; Sun, et al., 2023). En el secado por aspersión la elección de los agentes encapsulantes o material de cobertura es crítica, ya que pueden intervenir en las propiedades de la emulsión antes del secado, tamaño de partícula y propiedades de flujo, así como en la retención de compuestos volátiles durante el proceso y en la vida útil del polvo después del secado.
Un factor de gran importancia son los agentes encapsulantes utilizados, dentro de los cuales podemos encontrar diferentes tipos como: los lípidos: grasa láctea, lecitinas, ceras, ácido esteárico, monoglicéridos, diglicéridos, aceites hidrogenados; son excelentes formadores de películas capaces de cubrir las partículas individuales, proporcionando una encapsulación uniforme. Los hidratos de carbono son ampliamente utilizados, principalmente con la técnica de secado por aspersión como soporte de encapsulamiento, dentro de este grupo se encuentran los almidones, maltodextrinas y gomas. Hoy día se está estudiando el uso de matrices micro encapsulantes poliméricas provenientes de polisacáridos y sus posibles combinaciones que permitan la correcta conservación de la capa encapsulante y del material activo a encapsular. (Nie, 2013; Esquivel‐González, et al., 2015; Fritzen-Freire, et al., 2021; Madsen, et al., 2022; Mikkel et al., 2022).
El material protector debe reunir ciertas propiedades que dependen de las características químicas del material encapsulado, la aplicación, las condiciones de almacenamiento y del proceso expuesto por (Nag, 2011; Moumita, et al., 2017; Homayouni-Rad et al., 2021). El primer paso en la encapsulación es la selección de una matriz de encapsulación adecuada (Rios-Aguirre, y Gil-Garzon, 2021; Tamtürk, et al., 2023). Las investigaciones en torno a este tema, se centran en la búsqueda y aplicación de nuevos materiales de recubrimiento y técnicas novedosas de encapsulación. (Ávila-Reyes, 2014; Ceja-Medina, et al., 2021; Barros, et al., 2022).
En esta investigación, se evaluaron tres materiales los cuales se escogieron por poseer propiedades encapsulantes y prebióticas para someterlos al secado por aspersión en un equipo marca© Vibrasec. El almidón de yuca nativo (Manihot sculenta Crantz) y el alginato de sodio han sido investigados por su habilidad de ser utilizados como material de pared para la encapsulación, tienen amplia distribución de tamaño (Aristizábal, y Sánchez, 2007; Lupo-Pasin et al., 2012; Etchepare, et al., 2016). En la encapsulación de probióticos, se usa en concentraciones moderadas sin embargo presenta poca resistencia a los ácidos gástricos, esta característica puede ser contrarrestada al modificar la estructura del gel, al emplear sistemas mixtos poliméricos para la formación de la matriz o con el recubrimiento de las macropartículas (Lupo-Pasin et al., 2012; El-Sayed, et al., 2017; Tao, T., et al., 2019; Triviño, 2019).
La harina de avena contiene almidones, β - α Glucanos y pequeñas cantidades de proteínas que lo hacen un material prebiótico con la posibilidad de formar películas fuertes, resistentes y flexibles para mejorar las propiedades del alginato y el almidón de yuca nativo (Ta, et al., 2021). El beta-glucano de la avena puede llevar a la declaración de salud aprobada por la FDA (Yonekura, et al., 2014; Yuan, et al., 2023 17). Diversos estudios han publicado algunas características fisicoquímicas y reológicas de los principales componentes de la avena, destacándose los trabajos realizados por (Berski, et al., 2011; Zamora-Vega, et al., 2012; Zamudio-Flores, et al., 2015; Flores-Peña, et al., 2013).
Las investigaciones en torno a este tema se centran en la búsqueda y aplicación de nuevos materiales de recubrimiento para someterlos al secado por aspersión. Por lo que en esta investigación se planteó evaluar las características fisicoquímicas (contenido de sólidos y temperatura de gelatinización) de una mezcla de materiales poliméricos naturales con características prebióticas para encapsular una mezcla de microorganismos mediante la técnica de secado por aspersión, para definir la concentración adecuada cumpliendo las restricciones de viscosidad del equipo © Vibrasec.
2. MATERIALES Y MÉTODOS
El trabajo de experimentación se realizó en: Laboratorio de Nanotecnología, Centro de Tecnología de Alimentos en la Universidad de Pamplona, el Laboratorio de Ingeniería Aplicada y el Laboratorio de Bioprocesos y Fermentaciones sede Berastegui de la Universidad de Córdoba, Colombia.Como agentes encapsulantes se utilizaron: Almidón de yuca nativo, (INNOVAYUCA), Alginato de sodio (SQ 942) y Harina de avena molida.
2.1. Caracterización material encapsulante y disoluciones
Se realizó la evaluación fisicoquímica al material encapsulante y las disoluciones, cómo se describe a continuación:Tabla 1: Análisis realizados a los materiales encapsulantes y disoluciones
| Parámetros Evaluados | Método Utilizado |
|---|---|
| Análisis granulométrico | AOAC. 965.22, (1995) |
| Contenido de humedad (%) | Método gravimétrico por volatilización |
| Densidad aparente (g/mL) | Goula, A. M., y Adamopoulos, K. G. (2012) |
| Temperatura Vítrea | Paredes-López, O., et al., (1994) |
| Viscosidad aparente de las disoluciones | Viscosímetro de Brookfield Nielsen (2010) |
| Densidad aparente de las disoluciones | A.O.A.C. 962.37, (1995) |
| pH | Método potenció-métrico AOAC 981.12 (2012) |
| Acidez como ácido láctico. (% m/m) min | Titulación con NaOH AOAC. (942.15, 2005) |
Una vez se estableció la concentración de sólidos y temperatura vítrea (Tg) de los tres materiales encapsulantes, se realizaron ensayos para definir la máxima concentración de sólidos a trabajar por material de manera individual y con la mezcla de los materiales en suspensión: pruebas de calentamiento a diferentes concentraciones de sólidos frente a la viscosidad aparente y cumplir la restricción en la viscosidad exigida para el uso del equipo © Vibrasec, técnica empleada por (Nielsen, 2010; Aristizábal, y Sánchez, 2007).
2.2 Evaluación estadística de los datos
Todas las mediciones para los análisis estadísticos se realizaron por triplicado. Para evaluar estadísticamente cada uno de los ensayos realizados en la experimentación, se determinaron las diferencias significativas entre los tratamientos, realizando un análisis ANOVA con un intervalo de confianza del 95 % y un análisis de comparaciones multiples Tukey de los valores promedios.3. RESULTADOS
3.1. Análisis granulométrico de la harina de avena y almidón de yuca nativo
El análisis granulométrico realizado a los materiales encapsulantes: harina de avena y almidón de yuca nativo permitió conocer la distribución del tamaño de las partículas, (Flores-Peña,, et al., 2013; Aristizábal, y Sánchez, 2007).
(a)

(b)
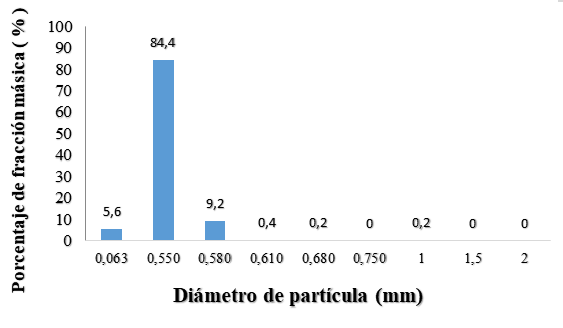
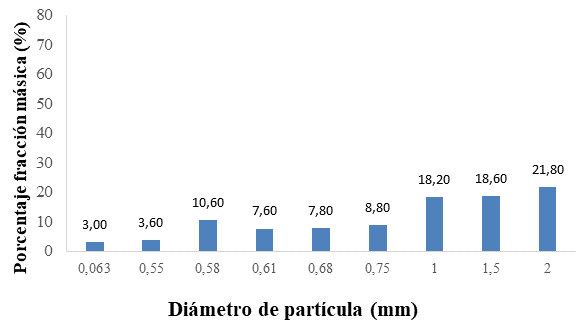
Fig. 1. Distribución del diámetro de partícula de la (a) harina de avena y (b) el almidón de yuca nativo.
La Figura 1 muestra la distribución del diámetro de partícula de la harina de avena, (84.40 %) con un tamaño de partícula de 0.55 mm, con un diámetro promedio de 0.53 mm correspondiendo a un producto de molienda fina (49, 66). El tamaño de la partícula y la capa superficial de la harina de avena por su alto contenido en fibra alimentaria, influyen en las propiedades fisicoquímicas de la matriz encapsulante que se requiere, favoreciendo la disolución y homogenización con los demás materiales a mezclar. De igual forma se presenta el análisis granulométrico del almidón de yuca nativo (Manihot sculenta Crantz), con una distribución del tamaño de partícula no homogénea, donde el 58.6 % estuvo en el intervalo de 1 a 2 mm y un intervalo promedio de 0.54 mm (41.4 %), para un diámetro promedio de partícula del almidón de yuca de 1.14 mm que corresponde a un polvo de categoría muy fina (Flores-Peña, et al., 2013; CODEX STAN 176. 1989; De Araujo, et al., 2016).Fig. 1. Distribución del diámetro de partícula de la (a) harina de avena y (b) el almidón de yuca nativo.
Los resultados del análisis granulométrico de los materiales encapsulantes, evidencian diferencias en el tamaño de partícula entre la harina de avena y el almidón de yuca nativo (Manihot sculenta Crantz), de fina a muy fina, aspecto que se tuvo en cuenta para el proceso de mezclado, estableciendo que en la preparación de la matriz encapsulante debía efectuarse en forma húmeda (disolución) para evitar que ocurriera el fenómeno de disgregación, lo que dificultaría el mezclado, en atención a lo expuesto por (Esquivel‐González, et al., 2015) quienes establecieron que un mayor número de poros permiten mayor hidratación de la partícula y una superficie disponible facilita la unión de cationes; de ahí radica la importancia de una granulometría fina en los materiales encapsulantes a emplear.
3.2. Indicadores físico- químicos de los materiales encapsulantes
La Tabla 2 presenta los resultados de los indicadores analizados:Tabla 2: Indicadores físico- químicos de los materiales encapsulantes
| Material encapsulante | Densidad aparente (g/mL) | Contenido de Humedad (%) | Valor de pH |
|---|---|---|---|
| Harina de avena | 1.082 (0.01) | 14.67 (0.01) | 7.0 (0.01) |
| Almidón de yuca nativo | 1.530 (0.03) | 12.53 (0.04) | 6.5 (0.03) |
| Alginato de sodio | 0.990 (0.01) | 12.27 (0.07) | 7.0 (0.02) |
Valores medios informados corresponden a 3 determinaciones
Como se observa en la Tabla 2 los materiales encapsulantes presentaron pH, densidad aparente y contenido de humedad dentro de los intervalos de las normas (García-Ceja, y López-Malo, 2012; Madsen, et al., 2022) siendo adecuados para formar cápsulas de diferentes tamaños a causa de las interacciones moleculares de los diferentes materiales poliméricos a combinar (Barbosa-Cánovas, 2005; Lupo-Pasin, et al., 2012; Arslan, S., Erbas, M., Tontul, I., Y Topuz, 2015).
3.3. Calorimetría diferencial de barrido (DSC) del material encapsulante
En la tabla 3 se presentan los valores de temperatura vítrea (Tg) del material encapsulante.Tabla 3: Temperaturas de transición vítrea (Tg) de los materiales encapsulantes.
| Material encapsulante | Temperatura vítrea, Tg (°C) |
|---|---|
| Alginato de sodio | 85 |
| Almidón de yuca nativo | 63 |
| Harina de avena | 62 |
Los resultados de calorimetría (DSC) permitieron evaluar si los materiales encapsulantes a trabajar presentaban incompatibilidad dentro de las formulaciones tanto de los componentes individuales como en mezcla. Como se observa en la tabla 3 la temperatura vítrea de los tres materiales se encuentra en un rango 62 -85 °C de temperatura de transición vítrea (Tg) lo que favorece obtener adecuadas condiciones para las disoluciones al momento de realizar las diferentes mezclas (Perdomo, et al., 2009; Ceja-Medina, et al., 2020). Este resultado indica que la temperatura de alimentación de los materiales encapsulantes debe trabajarse a temperaturas inferiores a 63 oC, para el caso del almidón de yuca nativo (Manihot sculenta Crantz) y la harina de avena pudiera ser 60 oC para facilitar su solubilización sin que gelatinice (Richardson, et al., 2000), mientras que el alginato de sodio debe trabajarse a una temperatura menor a los 85 °C, por lo que se deben preparar por seprarado antes de mezclarse.
3.4. Viscosidad aparente de los materiales encapsulantes
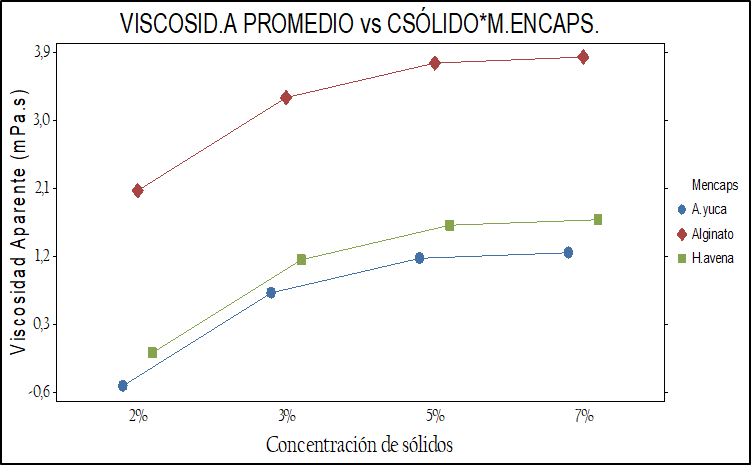
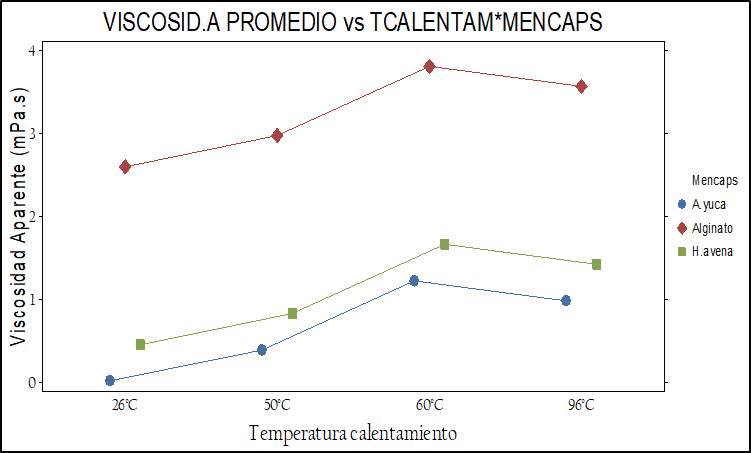
Una de las restricciones del equipo de secado (© Vibrasec) para su uso, fue la viscosidad de los materiales encapsulantes que no debe ser superior a 700 mPa.s. En la figura 2 se presenta gráficamente el comportamiento de la viscosidad aparente en los tres materiales encapsulantes frente a las tres concentraciones evaluadas.
(a)

(b)
Fig. 2. Comportamiento de la viscosidad aparente de los tres materiales encapsulantes (a) frente a la temperatura de calentamiento y (b) concentración de sólidos.
El análisis estadístico de los p-valor<0.05 indican que la viscosidad aparente varía según el material encapsulante, la temperatura de calentamiento y la concentración de sólidos evaluados (ver figura 2).Fig. 2. Comportamiento de la viscosidad aparente de los tres materiales encapsulantes (a) frente a la temperatura de calentamiento y (b) concentración de sólidos.
En la tabla 4 se presenta los resultados del análisis de comparaciones multiples Tukey de los valores promedios.
Tabla 4: Resumen del análisis de comparaciones multiples Tukey de los valores promedios de viscosidad aparente.
| Técnica estadística: ANOVA | |||||
|---|---|---|---|---|---|
| Prueba de comparaciones múltiples: Tukey | |||||
| Nivel de significancia: α =5% | |||||
| Software estadístico: Statistix versión 10 | |||||
| Variables | Factores | Nivel Factor | Media | P-Valor | Interpretación |
| VISCOSIDAD APARENTE | Material encapsulante | Alginato | 3,239a | 0.000 | Hay diferencias |
| Harina de avena | 1,092b | ||||
| Almidón de yuca | 0,654c | ||||
| Concentración de sólidos (%) | 7 | 2,2546a | 0.001 | Hay diferencias | |
| 5 | 2,1796a | ||||
| 3 | 1,7218b | ||||
| 2 | 0,4923c | ||||
| Temperatura de calentamiento (°C) | 60 | 2,2327a | 0.000 | Hay diferencias | |
| 50 | 1,9927ab | ||||
| 96 | 1,3978b | ||||
| 26 | 1,0251b | ||||
La viscosidad aparente con mayor promedio se presentó con el alginato de sodio (Nielsen, 2010; Holkem, et al., 2016), seguidamente con el almidón de yuca nativo y la harina de avena siendo este último el que menos viscosidad presento en las temperaturas y concentraciones evaluadas. Así mismo la viscosidad aparente promedio varía en los tres materiales según la concentración de sólidos. A las concentraciones de 7% y 5% se produce una viscosidad estadísticamente muy parecida entre la harina de avena y el almidón de yuca nativo (Karimi, et al., 2023), (ver tabla 4).
De otra parte, la viscosidad aparente en los tres materiales varía según la temperatura de calentamiento, observando que la harina de avena y el almidón de yuca presentaron una viscosidad similar a temperaturas entre 50 y 60 °C mientras el alginato de sodio presento los valores más altos de viscosidad a medida que aumentaba la temperatura y la concentración de sólidos, igualmente se observa que a la temperatura de 60 °C se presenta la viscosidad promedio más alta. (De Araujo, et al., 2016).
La Tabla 5 muestra los resultados de la viscosidad de las disoluciones de alginato de sodio a temperaturas de 60 y 96 °C, teniendo en cuenta la capacidad de absorción de agua a diferentes concentraciones de sólidos de 2 y 3 % (p/v) dado que el valor máximo reportado para su uso como material encapsulante de probióticos ha sido de 5 % (Rios-Aguirre, et al., 2021).
Tabla 5: Viscosidad aparente del alginato de sodio a diferente concentración de sólidos y temperaturas.
| Agente encapsulante | Viscosidad aparente (mPa.s) | |||
|---|---|---|---|---|
| Concentración sólidos / Temperatura (°C) | ||||
| 2 / 60 | 2 / 96 | 3 / 60 | 3 / 96 | |
| Alginato de sodio | 404.6 (0.01) | 1,040.6 (0.01) | 4,296.6 (0.01) | 7,490.0 (0.01) |
Valores medios informados corresponden a 3 determinaciones. p-valor<0.05
Los resultados de la tabla 5 muestran que en el alginato de sodio el intervalo de temperatura de 60 a 96 ± 1 °C la viscosidad aparente aumentó de 404.6 a 7,490 mPa.s, por encima del valor máximo (700 mPa.s) permitido para el uso del equipo de secado, por lo que se definió que la solución de alginato de sodio debe preparase a una concentración de sólidos no mayor del 2 % con constate agitación para facilitar su solubilidad.Resultados que corroboran lo expuesto por (Perdomo, et al., 2009; Wan et al., 2010; Mikkel., et al., 2022) la viscosidad de las soluciones de alginato depende de la concentración, a partir del 2 % la viscosidad de la solución aumenta considerablemente y tiene un comportamiento no newtoniano, su viscosidad no es constante.
En la Tabla 6 se presentan los resultados de viscosidad aparente de las disoluciones de almidón de yuca nativo y la harina de avena a concentraciones de 3, 5 y 7 % a una temperatura de 60 °C.
Tabla 6: Evaluación de la viscosidad aparente del almidón de yuca nativo y la harina de avena a diferente concentración de sólidos a 60 °C.
| Material | Viscosidad aparente (mPa.s) | ||
|---|---|---|---|
| Concentración de sólidos (%) | |||
| 3 | 5 | 7 | |
| Almidón de yuca nativo | 189.2 (0.07) | 356.7 (0.01) | 653.7 (0.01) |
| Harina de avena | 6.8 (0.00) | 10.1 (0.00) | 34.5 (0.00) |
Determinaciones se realizaron por triplicado, reportándose el valor promedio. p-valor<0.05
Como se observa en la Tabla 6, la viscosidad del almidón de yuca nativo aumenta en la medida que aumenta la concentración y no sobrepasa el valor de viscosidad máximo requerido (700 mPa.s) por lo que el almidón de yuca nativo puede utilizarse hasta una concentración máxima de 7 % a una temperatura de 60 oC. Así mismo se observó un aumento gradual de la viscosidad aparente a medida que se incrementó la concentración de la harina de avena en la dispersión, los valores medios de la viscosidad de las disoluciones oscilaron desde 6.8 a 34.5 mPa.s, encontrándose por debajo del valor tomado como restricción, por lo que la harina de avena puede ser empleada en concentraciones por encima del 7 % a una temperatura de 60°C.Estos resultados coinciden con los reportados por (Dikeman, y Fahey. 2006; Lazaridou, y Biliaderis, 2007; Regand, et al., 2011; Rodríguez‐Restrepo, et al., 2017; Zamudio-Flores, et al., 2021), quienes indican que los incrementos en los valores de viscosidad aparente entre las dispersiones están directamente asociados al mayor contenido de fibra en las concentraciones mayores debido a la presencia de -glucanos en la harina de avena.
La Tabla 7 muestra la viscosidad aparente de las mezclas de materiales encapsulantes en suspensión a la temperatura de trabajo definida (60 ° C) a diferente concentración de sólidos.
Tabla 7: Viscosidad aparente de mezclas de materiales encapsulantes en suspensión.
| Concentración de sólidos (%) | Alginato de sodio (%) | Almidón yuca nativo (%) | Harina avena (%) | Viscosidad aparente (mPa.s) |
|---|---|---|---|---|
| 16 | 1 | 7 | 8 | 796 (0.3) |
| 14 | 1 | 7 | 6 | 693 (0.4) |
| 12 | 1 | 5 | 6 | 495 (0.6) |
| 10 | 1 | 5 | 4 | 253 (0.4) |
Determinaciones se realizaron por triplicado, reportándose el valor promedio. p-valor<0.05
Como se observa, tabla 7 para valores de sólidos en mezcla del 16 %, la viscosidad estuvo por encima de 700 mPa.s, no cumpliendo con las restricciones exigidas del equipo de secado. Mientras que las mezclas con concentraciones de sólidos en el rango de 10 a 14 % se encuentran con valores de viscosidad menor al declarado como restricción de trabajo. En la Tabla 8 se puede apreciar el comportamiento de las mezclas de los materiales encapsulantes sometidas al secado por aspersión en el equipo Vibrasec.
Tabla 8: Comportamiento de la mezcla de materiales en suspensión a diferentes concentraciones de sólidos en el equipo Vibrasec.
| Concentración sólidos (%) | Temperatura entrada de aire (°C) | Velocidad atomización (min-1) | Comportamiento en la cámara | Contenido humedad (%) |
|---|---|---|---|---|
| 20 | 200 | 35,000 | Saturación | --- |
| 16 | 200 | 35,000 | Saturación | 9.23 |
| 14 | 200 | 35,000 | Saturación | 8.68 |
| 12 | 200 | 35,000 | Normal | 4.58 |
| 10 | 200 | 35,000 | Normal | 4.32 |
A partir de estos resultados, las mezclas del material encapsulante fueron sometidas al proceso de secado por aspersión a una temperatura de alimentación de 60 °C, a temperaturas de entrada de aire de 200 °C, como se observa en la tabla 8 las concentraciones de sólidos de 14 y 16 % presentaron saturación en la cámara y una humedad entre 8.68 y 9.23 %, resultados que concuerdan con lo expuesto por (Rios-Aguirre, et al., 2021; Salinas, et al., 2021; Tamtürk, et al., 2023), quienes indican que la temperatura de aire de entrada es directamente proporcional a la velocidad de secado de las microcápsulas y al contenido de agua final, ya que al tener mayor humedad adsorbida, las fuerzas de cohesión entre partículas tenderán a ser mayores, es decir, que van a haber mayores puentes de contacto entre ellas lo cual, puede afectar indirectamente la velocidad de dispersión de los materiales encapsulantes reflejado en la saturación de la cámara de secado. Mientras que las concentraciones de 10 y 12 % de sólidos tuvo un comportamiento normal en la cámara y una humedad entre 4.58 y 4.32 %.
Este resultado permitió seleccionar la concentración del 12 % de sólidos como la más apropiada de las mezclas del material encapsulante en suspensión a emplear en el secado por aspersión bajo las condiciones evaluadas del equipo © Vibrasec, descartando la concentración del 10 % por considerar muy bajo el contenido de sólidos (Soto, et al., 2023; Tamtürk, et al., 2023).
4. CONCLUSIONES.
Se concluye que la harina de avena, el almidón de yuca nativo y el alginato de sodio poseen propiedades fisicoquímicas que favorecen su utilización como material encapsulante, seleccionando la concentración del 12 % de sólidos como la más apropiada de las mezclas del material encapsulante en suspensión a emplear en el secado por aspersión.CONTRIBUCIONES DE LOS AUTORES
Todos los autores participaron por igual en el desarrollo y redacción de esta investigación.DECLARACIÓN DE INTERÉS COMPETENTE
Los autores declaran no tener conflicto de interés.REFERENCIAS
A.O.A.C. 962.37. (1995). Official Methods of Analysis. Association of Official Analytical Chemist. EUA.A.O.A.C. 965.22. (1995). Official Methods of Analysis. Association of Official Analytical Chemist. EUA. Análisis granulometrico para harinas.
A.O.A.C. 981.12. (2012). Official Methods of Analysis. Association of Official Analytical Chemist. EUA. pH.
AOAC. (942.15, 2005). Official Methods of Analysis. Association of Official Analytical Chemist. EUA. Acidez.
Aristizábal, J., y Sánchez, T. (2007). Guía técnica para producción y análisis de almidón de yuca. Boletín de servicios agrícolas de la FAO 163. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma, Pp. 153.
Arslan, S., Erbas, M., Tontul, I., Y Topuz, A. (2015). Microencapsulation of probiotic Saccharomyces cerevisiae var. boulardii with different wall materials by spray drying. LWT-Food Science and Technology, 63(1), 685-690.
Ávila-Reyes, S. V, y otros cuatro autores, (2014). Protection of L. rhamnosus by spray-drying using two prebiotics colloids to enhance the viability, doi:https://doi.org/10.1016/j.carbpol.2013.11.033, Carbohydrate Polymers, 102, 423 -432.
Barbosa-Cánovas, G. V. (2005). Compression and Compaction Characteristics of Selected Food Powders. En Advances in Food and Nutrition doi:10.1016/S1043-4526. Research. Academic Press, Vol. 49 , págs. 233-307.
Barros, Cp, Silva, R., Guimarães, Jt, Balhtazar, Cf, Verruck, S., Pimentel, Tc, ... & Da Cruz, Ag (2022). Prebióticos y simbióticos en alimentos funcionales. https://doi.org/10.1002/9781119776345.ch2. Alimentos funcionales, 21-53.
Berski, W., A. Ptaszek, P. Ptaszek, R. Ziobro, G. Kowalski, M. Grzesik and B. Achremowicz. (2011). Pasting and rheological properties of oat starch and its derivatives. https://doi.org/10.1016/j.carbpol.2010.08.036. Carbohydrate Polymers 83.: 665-671.
Ceja-Medina, L. I., L. y otros siete autores, (2021). In vitro synbiotic activity of Lactobacillus plantarum encapsulated with mixtures of Aloe vera mucilage, agave fructans and food additives as wall materials, https://doi.org/10.24275/rmiq/Bio2234, Revista Mexicana de Ingeniería Química, ISSN-E: 2395-8472, ISSN:1665-2738, 20 (2): 711–723.
Ceja-Medina, L. I., R. I. Ortiz-Basurto, L. Medina-Torres, F. Calderas, M. J. Bernad-Bernad, R. F. González-Laredo, J. A. Ragazzo-Sánchez, M. Calderón-Santoyo, M. González-Ávila, I. Andradegonzález & O. Manero. (2020). Microencapsulation of Lactobacillus plantarum by spray drying with mixtures of Aloe vera mucilage and agave fructans as wall materials. https://doi.org/10.1111/jfpe.1343. Journal of Food Process Engineering. 43(8): e13436.
CODEX STAN 176. (1989). Norma del Codex Para la Harina de Yuca Comestible.
De Araujo, Scratch Etchepare, M., Raddatz, GC, Cichoski, AJ, Flores, É.M M , Barin , JS , Zepka , LQ , ... & de Menezes , C R. (2016). Efecto del almidón resistente (Hi-maize) sobre la supervivencia de Lactobacillus acidophilus microencapsulado con alginato de sodio. Revista de Alimentos Funcionales, 21, 321–329.
Dikeman, C. L. and G. C. Fahey. (2006). Viscosity as related to dietary fiber: A review. Critical https://doi.org/10.1080/10408390500511862. Reviews in Food Science Nutrition 46 (8):649-663.
Eckert, C. y otros siete autores, (2017). Microencapsulation of Lactobacillus plantarum ATCC 8014 through spray drying and using dairy whey as wall materials, https://doi.org/10.1016/j.lwt.2017.04.045, LWT Food Sci. Technol. 82, 176–183.
El-Sayed, H. S., Kassem, J. M., El-Shafei, K. A. W. T. H. E. R., Assem, F. M., & Sharaf, O. M. (2017). Comparative evaluation of the microencapsulation methods efficiency to protect probiotic strains in simulated gastric conditions. International Journal of Biology, Pharmacy and Allied Science, ISSN: 2277–4998, 6(3), 521-545.
Esquivel‐González, B., Ochoa Martínez, L., y Rutiaga-Quiñones, O. (2015). Microencapsulación mediante secado por aspersión de compuestos bioactivos. https://www.redalyc.org/pdf/813/81343176006.pdf. Revista Iberoamericana de Tecnología Postcosecha, 16(2), 180-192.
Etchepare, M., Raddatz, G. C., Cichoski, A. J., Flores, E. M., Barin, J. S., Queiroz, Z. L., y de Menezes, C. R. (2016). Effect of resistant starch (Himaize) on the survival of Lactobacillus acidophillus microencapsulated with sodium alginate. doi:DOI: 10.1016/jff2015.12025. Journal of Functional Foods, 21, 321-329.
Flores-Peña, F. F.; Lozano-Quezada, F.Y.; Ramos-Martínez, A.; Salgado-Delgado, R.; Guerrero-Prieto, V. M.; Ramírez-Mancinas, S.; Bello-Pérez, L. A.; y Zamudio-Flores, P. B. (2013). Caracterización fisicoquímica, reológica y funcional de harina de avena (Avena sativa L. cv Bachíniva) cultivada en la región de Cuauhtémoc, Chihuahua. DOI: https://doi.org/10.54167/tch.v8i3.611. Revista Tecnociencia. Chihuahua. Vol. VIII, Núm. 3.
Fritzen-Freire, C. B. et al., (2021). Microencapsulation of bifidobacteria by spray drying in the presence of prebiotics. Available from: Accessed: Nov. 18, doi: 10.1016/j.foodres.2011.09.020, Food Research International, v. 45, p. 306-312.
Fuchs, M., Turchiuli, C., Bohin, M., Cuvelier, M., Ordonnaud, C., Peyrat-Maillard, M., y Dumoulin, E. (2006). Encapsulation of oil in poder using spray drying and fluidized bed agglomeration. https://doi.org/10.1016/j.jfoodeng.2005.03.047. Journal of Food Engineering, 75(1), 27 -35.
Gandomi, H., y otros cuatros autores, (2016). Effect of chitosan-alginate encapsulation with inulin on survival of Lactobacillus rhamnosus GG during apple juice storage and under simulated gastrointestinal conditions, https://doi.org/10.1016/j.lwt.2016.01.064.LWT-Food Science and Technology, 69, 365-371.
García, A., & López, A. (2012). Biopolímeros utilizados en la encapsulación. 6 (1). 84-97. Departamento de Ingeniería Química, Alimentos y Ambiental, Puebla, Recuperado de: https://www. udlap. mx/wp/tsia/files/No6, 1.
Goula, A. M., y Adamopoulos, K. G. (2012). A method for pomegranate seed application in food industries: Seed oil encapsulation,. Food and Bioproducts Processing, 90 (4), 639-652. doi:https://doi.org/10.1016/j.fbp.2012.06.001.
Holkem, At, Raddatz, Gc, Nunes, Gl, Cichoski, Aj, Jacob-Lopes, E., Grosso, Crf Y De Menezes, Cr (2016). Desarrollo y caracterización de microcápsulas de alginato que contienen Bifidobacterium BB-12 producidas por emulsificación/gelificación interna seguida de liofilización. https://doi.org/10.1016/j.lwt.2016.04.012. LWT-Ciencia y tecnología de los alimentos,71, 302-308.
Homayouni-Rad, y otros cuatro autores, (2021). Effect of Alyssum homolocarpum mucilage and inulin microencapsulation on the survivability of Lactobacillus casei in simulated gastrointestinal and high - temperature conditions, https://doi.org/10.1016/j.bcab.2021.102075., Biocatalysis and Agricultural Biotechnology 35: 102075.
Karimi, R., y otros cuatro autores, (2023). Interaction between β-glucans and gut microbiota: a comprehensive review, https://doi.org/10.1080/10408398.2023.2192281, Critical Reviews in Food Science and Nutrition, 1-32.
Lazaridou, A., & Biliaderis, C. G. (2007). Molecular aspects of cereal β-glucan functionality: Physical properties, technological applications and physiological effects. https://doi.org/10.1016/j.jcs.2007.05.003.Journal of cereal science, 46(2), 101-118.
Lupo-Pasin B, González A. C., Maestro G. A. (2012). Microencapsulación con alginato en alimentos. Técnicas y aplicaciones. Revista Venezolana de Ciencia y Tecnología de Alimentos., 3 (1):(2218-4384), 130-151.
Madsen, M., y otros cuatro autores, Simulated gastrointestinal digestion of protein alginate complexes: effects of whey protein cross-linking and the composition and degradation of alginate. https://doi.org/10.1039/D2FO01256A, Food & Function, 13(16), 8375-8387, (2022).
Mikkel Madsen, Mette E. Rønne, Ruifen Li, Ines Greco, Richard Ipsen y Birte Svensson. (2022). Digestión gastrointestinal simulada de complejos de proteína de alginato: efectos del entrecruzamiento de la proteína de suero y la composición y degradación del alginatohttps://doi.org/10.1039/D2FO01256A. This journal is © The Royal Society of Chemistry. Food Funct. volumen13, Pp 8375-8387. N° 16.
Moumita, S. et al., (2017). Evaluation of the viability of free and encapsulated lactic acid bacteria using in-vitro gastro intestinal model and survivability studies of symbiotic microcapsules in dry food matrix during storage. Doi: 10.1016/j.lwt.2016.11.079. LWT- Food Science and Technology, v. 77, p. 40-477.
Nag, A. (2011). Development of microencapsulation technique for probiotic bacteria Lactobacillus casei 431 using a protein polysaccharide complex. New Zealand: Massey University. http://hdl.handle.net/10179/2355.
Nie, S. P., Wang, C., Cui, S. W., Wang, Q., Xie, M. Y., & Phillips, G. O. (2013). A further amendment to the classical core structure of gum Arabic (Acacia senegal). https://doi.org/10.1016/j.foodhyd.2012.09.014. Food Hydrocolloids, 31(1), 42e48.
Nielsen, S. (2010). Viscosity Measurement Using a Brookfield Viscometer. Chapter 20. DOI: 10.1007/978-1-4419-1463-7_20. Food analysis laboratory manual (2), 167 – 168.
Nunes, G. L. et al., (2017). Inulin, hi-maize, and trehalose as thermal protectants for increasing viability of Lactobacillus acidophilus encapsulated by spray drying. Doi: 10.1016/j.lwt.2017.10.032. LWT- Food Science and Technology, v. 89, p. 128-133.
Paredes-López, O., Bello-Pérez, L. A., y López, M. G. (1994). Amylopectin: Structural, gelatinisation and retrogradation studies. Obtenido de https://doi.org/10.1016/0308-8146(94)90215-1. Food Chemistry, 50(4), 411-417.
Perdomo, J., Cova, A., Sandoval, A., García, L., Laredo, E., y Müller, A. (2009). Glass transition temperature and water sorption isotherms of cassava starch. https://doi.org/10.1016/j.carbpol.2008.10.023. Carbohydrate Polymers, 76, 305–310.
Regand, A., Z. Chowdhury, S. M. Tosh, T. M. S. Wolever and P. Wood. (2011). The molecular weight, solubility and viscosity of oat beta-glucan affect human glycemic response by modifying starch digestibility. https://doi.org/10.1016/j.foodchem.2011.04.053. Food Chemistry 129 : 297-304.
Rios-Aguirre, Sara y Gil-Garzon, Maritza Andrea. (2021). Microencapsulación por secado por aspersión de compuestos bioactivos en diversas matrices: una revisión. https://doi.org/10.22430/22565337.1836. TecnoL.[online]. vol.24, n.51, pp.206-229. ISSN 0123-7799.
Rodríguez, Y.A., Rojas, A.F., Rodríguez-Barona, S. (2016). Encapsulación de probióticos para aplicaciones alimenticias. Doi: 10.17151/biosa.2016.15.2.10. Revista Biosalud; 15(2): 106-115.
Rodríguez‐Restrepo, Y. A., Giraldo, G. I., & Rodríguez‐Barona, S. (2017). Solubility as a fundamental variable in the characterization of wall material by spray drying of food components: application to microencapsulation of Bifidobacterium animalis subsp. lactis. https://doi.org/10.1111/jfpe.12557. Journal of Food Process Engineering, 40(6), e12557.
Salinas, R. R., Loaiciga, V. Z., & Jaramillo, S. H. (2021). Probióticos: desafíos, revisión y alcance. https://doi.org/10.31434/rms.v6i6.686. Revista Médica Sinergia, 6 (6), e686-e686.
Soto, J. G. M., y otros cinco autores, (2023). Recent developments on wall materials for the microencapsulation of probiotics: A review, DOI: https://doi.org/10.54167/tch.v17i1.1140. Tecnociencia Chihuahua, 17(1), e1140-e1140.
Sun, Weizhe, Quang D. Nguyen, Botond Kálmán Süli, Firas Alarawi, Anett Szécsi, Vijai Kumar Gupta, László Ferenc Friedrich, Attila Gere, And Erika Bujna. (2023). Microencapsulación y Aplicación de Bacteria Probiótica Lactiplantibacillus plantarum 299v Cepa. Microorganismos, 11 (4), 947. https://doi.org/10.3390/microorganisms11040947.
Ta, L. P., y otros seis autores, (2021). Effects of various polysaccharides (alginate, carrageenan, gums, chitosan) and their combination with prebiotic saccharides (resistant starch, lactosucrose, lactulose) on the encapsulation of probiotic bacteria Lactobacillus casei 01 strain. International, https://doi.org/10.1016/j.ijbiomac.2021.04.170, Journal of Biological Macromolecules, 183, 1136-1144.
Tamtürk, F., Gürbüz, B., Toker, Ö. S., Dalabasmaz, S., Malakjani, N., Durmaz, Y., & Konar, N. (2023). Optimization of Chlorella vulgaris spray drying using various innovative wall materials. https://doi.org/10.1016/j.algal.2023.103115. Algal Research, 72, 103115.
Tao, T., y otros nueve autores, (2019). Influence of polysaccharide as co-encapsulant on powder characteristics, survival and viability of microencapsulated Lactobacillus paracasei Lpc-37 by spray drying, https://doi.org/10.1016/j.jfoodeng.2019.02.009, J. Food Eng, 252, 10–17.
Triviño Valencia, J. (2019). Efecto almacenamiento y las condiciones de estrés sobre la viabilidad de bifidobacterium animalis microencapsulado e incorporado en harina instantánea fortificada a base de plátano dominico hartón (Musa Aabsimmonds). Tesis (Magister en Microbiología Agroindustrial). Universidad Católica de Manizales. Instituto de Investigación en Microbiología y Biotecnología Agroindustrial. https://repositorio.ucm.edu.co/handle/10839/2532.
Wang., Q., Hu, X., Du, Y., y Kennedy, J. F. (2010). Alginate/starch blend fi bers and their properties for drug controlledrelease. https://doi.org/10.1016/j.carbpol.2010.06.004. Carbohydrate Polymers, 82(3), 842-847.
Yonekura, L., Sun, H., Soukoulis, C., Fisk, I. (2014). Microencapsulation of Lactobacillus acidophilus NCIMB 701748 in matrices containing soluble fibre by spray drying: Technological characterization, storage stability and survival after in vitro digestión. https://doi.org/10.1016/j.jff.2013.10.008. Journal of Functional Foods, 6, 205–214.
Yuan, C., y otros cuatro autores, (2023). Extraction and prebiotic potential of β-glucan from highland barley and its application in probiotic microcapsules, https://doi.org/10.1016/j.foodhyd., Food Hydrocolloids, 139, 108520.
Zamora-Vega, R., y otros seis autores, (2012), effect of incorporating prebiotics in coating materials for the microencapsulation of Sacharomyces boulardii.https://doi.org/10.3109/09637486.2012.687364. International journal of food sciences and nutrition, 63(8), 930-935.
Zamudio-Flores, P.B. et al. (2015), Digestibilidad in vitro y propiedades térmicas, morfológicas y funcionales de harinas y almidones de avenas de diferentes variedades. Rev. Mex. Ing. Quím [online]. vol.14, n.1 [citado 2023-06-06], pp.81-97. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1665-27382015000100008&lng=es&nrm=iso. ISSN 1665-2738.
Universidad de Pamplona
I. I. D. T. A.
I. I. D. T. A.