Revista Colombiana de
Tecnologías de Avanzada
Tecnologías de Avanzada
Recibido: 17 mayo de 2022
Aceptado: 16 julio de 2022
Aceptado: 16 julio de 2022
MODELAMIENTO MEDIANTE LA METODOLOGÍA DE SUPERFICIE DE RESPUESTA (RSM) DE LA PRODUCCIÓN DE HIDRÓGENO EN UN ELECTROLIZADOR SIN
MEMBRANA
MODELING BY RESPONSE SURFACE METHODOLOGY (RSM) OF HYDROGEN PRODUCTION IN A MEMBRANELESS ELECTROLYZER
 Ing. Mario Alejandro Muñoz León*,
Ing. Mario Alejandro Muñoz León*,
 PhD. Edwin García Quintero*,
PhD. Edwin García Quintero*,
 MSc. Héctor Darío Sánchez Londoño*.
MSc. Héctor Darío Sánchez Londoño*.
* Universidad de Antioquia, Facultad de ingeniería, Grupo de investigación TESLA.
Calle 70 #52-21, Medellín, Antioquia, Colombia.
Tel.: [57 + 604] 219 8332, Fax: [57 + 604] 263 8282
E-mail: {mario.munozl, edwin.garciaq, hector.sanchez1}@udea.edu.co
MODELING BY RESPONSE SURFACE METHODOLOGY (RSM) OF HYDROGEN PRODUCTION IN A MEMBRANELESS ELECTROLYZER
 Ing. Mario Alejandro Muñoz León*,
Ing. Mario Alejandro Muñoz León*,
 PhD. Edwin García Quintero*,
PhD. Edwin García Quintero*,
 MSc. Héctor Darío Sánchez Londoño*.
MSc. Héctor Darío Sánchez Londoño*.
* Universidad de Antioquia, Facultad de ingeniería, Grupo de investigación TESLA.
Calle 70 #52-21, Medellín, Antioquia, Colombia.
Tel.: [57 + 604] 219 8332, Fax: [57 + 604] 263 8282
E-mail: {mario.munozl, edwin.garciaq, hector.sanchez1}@udea.edu.co
Cómo citar: Muñoz León, M. A., Quintero, E. G., & Sánchez Londoño, H. D. (2022). MODELAMIENTO MEDIANTE LA METODOLOGÍA DE
SUPERFICIE DE RESPUESTA (RSM) DE LA PRODUCCIÓN DE HIDRÓGENO EN UN ELECTROLIZADOR SIN MEMBRANA. REVISTA COLOMBIANA DE TECNOLOGIAS DE AVANZADA
(RCTA), 2(40), 87-94.
https://doi.org/10.24054/rcta.v2i40.2356
Derechos de autor 2022 Revista Colombiana de Tecnologías de Avanzada (RCTA).
Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.

Resumen: En el presente trabajo se modela la producción de hidrógeno en un electrolizador sin membrana para soluciones de
KOH, NaCl y NaHCO3 con diferentes concentraciones, empleando la metodología de superficie de respuesta (RSM). Se encontró que el flujo de H2
puede explicarse en función del logaritmo de la potencia entregada y la concentración del electrolito, con un ajuste superior a 95% de acuerdo
con los modelos de regresión lineal propuestos a partir de datos obtenidos con un diseño experimental potencio-dinámico para cada tipo de
electrolito. Además, se halló un desempeño superior del KOH al 1M, produciendo 22 cm3 estándar por minuto (sccm) a 18W.
Palabras clave: Hidrógeno, Modelamiento, Electrolizador, Superficie de respuesta.
Abstract: In the present work, hydrogen production in a membrane-less electrolizer is modeled for KOH, NaCl and NaHCO3 solutions with different concentrations, using Responce Surface Methodology (RSM). It was found that the H2 flux can be explained as a function of the logarithm of the delivered power and the electrolyte concentration, with a fit better that 95% according to the linear regression models proposed from data obtained with a potentio-dynamic experimental desing for each type of electrolyte. In addition, a superior performance of 1M KOH was found, producing 22 cm3 standard per minute (sccm) at 18W.
Keywords: Hydrogen, Modeling, Electrolyzer, Response Surface.
El análisis energético del proceso de electrólisis puede evaluarse termodinámicamente utilizando el cambio de entalpía (ΔH) en la relación de la Ecuación (1).
\[ \Delta H = \Delta G + T \Delta S \hspace{1cm} (1)\]
Donde:
ΔG = Cambio en la energía libre de Gibbs
T = Temperatura
ΔS = Cambio de entropía
Considerando que ΔG es igual a -nEF, donde n es el número de cargas que intervienen en la reacción y F es la constante de Faraday, se puede calcular el potencial mínimo para la descomposición del agua (1.23V)
En la actualidad, destaca la investigación y posible uso industrial de la producción de hidrógeno con tres tipos de electrolito: líquido, membrana polimérica y membrana cerámica, las dos últimas son membranas sólidas de intercambio iónico específico (H+, OH-, O2-) que requieren principios de funcionamiento más complejos como altas temperaturas (80-1000°C), baja conductividad iónica a través de las membranas (OH-, O2-) y materiales caros (membranas y electrodos)
\[ 2H_2 O + 4e^- \rightarrow 4OH^- + 2H_2 \hspace{1cm} (2)\] \[ 4OH^- \rightarrow 2H_2O + O_2 + 4e^- \hspace{1cm} (3)\]
Típicamente, los materiales empleados para la fabricación de los electrodos utilizados en estos medios alcalinos son Ni, Co, Mo, Fe (aceros inoxidables) para el ánodo (
Debido al gran interés de los procesos de producción de hidrógeno, es necesario modelar el comportamiento en función de las variables más influyentes según el caso. La superficie de respuesta es una metodología de modelamiento con gran éxito en ciencia e ingeniería, ampliamente utilizada en diseño de experimentos para la interpolación de datos mediante el resultado de regresiones lineales utilizando las dos variables más significativas del modelo. El resultado final tiene la forma de la Ecuación (4).
\[ Y = \beta_0 + \beta_1 X_1 + \beta_2 X_2 +\beta_3 X_1 X_2 \hspace{1cm} (4)\]
Donde:
Y= Variable dependiente
X1, X2 = Variables independientes
β0 = Intercepto
βn = Coeficientes de las variables independientes y sus interacciones
Para el caso de estudio, Y sería la cantidad de hidrógeno generada y X1, X2 son las variables independientes explicativas más influyentes en el proceso (

El diseño experimental contempló un barrido de voltaje con saltos de 500mV/min, midiendo la corriente requerida por el electrolizador en un rango de potencia de 0-20W. Se consideraron los datos para los que había un flujo apreciable de gas a través del sensor (QH2 ≠ 0), como se ve en la Tabla 1. El voltaje y la corriente se relacionan con la potencia según la Ecuación 5.
\[ P = VI \hspace{1cm} (5)\]
Donde:
P = Potencia
V = Voltaje
I = Corriente
El hidrógeno se midió mediante el flujo de salida de la cavidad catódica del electrolizador, utilizando un sensor de flujo másico con principio de transferencia de calor, que no permitía correcciones por variaciones de temperatura y presión. Las unidades de lectura fueron en sccm, que, para el posterior análisis energético, permiten relacionar el caudal de hidrógeno producido (en g/min o cc/min en condiciones estándar) con la potencia aplicada (J/s).
Es importante destacar que las curvas obtenidas para cada concentración no tienen el mismo número de puntos, esto ocurre debido al mencionado aumento de la densidad de corriente en función del potencial aplicado, descrito por la ecuación de Butler-Volmer y el rango de potencias estudiado. El resultado final fue la obtención de datos para la modelización del flujo másico de hidrógeno en función de la potencia y de la concentración QH2 (P,c).
\[ Q_{(H_2)} = \beta_0 + \beta_1 \ln(P) + \beta_2 \ln(c) + \beta_3 \ln(P)\ln(c) \hspace{1cm} (6)\]
Los rangos de voltaje aplicados fueron de 2-9,5V para KOH, 3-13,5V para NaCl y 5-17,5V para NaHCO3 y sus respectivos rangos de densidad de corriente de 2-14mA/cm2, 0,5-11mA/cm2 y 0,5-8mA/cm2. Se puede confirmar que la mayor cantidad de hidrógeno se produce empleando como electrolito una solución 1M de KOH, alcanzando una producción de 22sccm a 18W (~6V), seguido de NaCl con 18sccm a 20W (~8V) y finalmente NaHCO3 con 11sccm a 20W (~11.5V).
En los tres modelos lineales se incluyeron las variables involucradas en la Ecuación (6), acorde al comportamiento de los resultados experimentales. De acuerdo con el p-valor, para cada uno de los tratamientos y los interceptos de las regresiones existe significancia (valor-p < α) excepto para la variable ln(c) en el caso del NaHCO3. A pesar de ello, dado que el término de interacción es significativo, esta variable no puede excluirse del modelo.
Los coeficientes muestran que ln(P) tiene el mayor efecto sobre el flujo de gas para los 3 modelos y es superior para KOH como se observa en los resultados experimentales. Los efectos de ln(c) son menores, principalmente para NaCl y NaHCO3 donde el aumento de concentración evidencia diferencias de 1-4 sccm en contraste con KOH donde para el mismo valor de potencia hay diferencias de hasta 10 sccm.
El término de interacción es significativo para los 3 modelos indicando que existe una fuerte dependencia entre la relación concentración-potencia y la producción de hidrógeno. Los modelos obtenidos se muestran en las Ecuaciones (6), (7) y (8), que obedecen a la forma de la Ecuación (4) propuesta inicialmente. Los modelos tienen ajustes de 0,97, 0,96 y 0,95 evidenciados en la Tabla 3, lo que indica una gran similitud con los resultados experimentales que pueden contrastarse con las superficies de respuesta de la Fig. 5.
\[ Q_{(H_2 KOH)}(P,c) = -9.05 + 10.28 \ln(P) - 3.17 \ln(c) + 3.54 \ln(P) \ln(c) \hspace{1cm} (7)\] \[ Q_{(H_2 NaCl)}(P,c) = -4.31 + 5.59 \ln(P) - 1.51 \ln(c) + 1.25 \ln(P) \ln(c) \hspace{1cm} (8)\] \[ Q_{(H_2 NaHCO_3)}(P,c) = -3.54 + 4.58 \ln(P) - 0.47 \ln(c) + 0.86 \ln(P) \ln(c) \hspace{1cm} (9)\]
Los mayores flujos de hidrógeno se alcanzan utilizando soluciones 1M de cada electrolito; en primer lugar, KOH (22sccm a 18W) seguido de NaCl (18 sccm a 20W) y finalmente NaHCO3 (11sccm a 20W). Del mismo modo, el flujo aumenta al aumentar la potencia del electrolizador, de acuerdo con las ecuaciones (6), (7) y (8).
Victoria, M., Haegel, N., Peters, I. M., Sinton, R., Jäger-Waldau, A., del Canizo, C., ... & Smets, A. (2021). Solar photovoltaics is ready to power a sustainable future. Joule, 5(5), 1041-1056.
Olabi, A. G., Wilberforce, T., Elsaid, K., Salameh, T., Sayed, E. T., Husain, K. S., & Abdelkareem, M. A. (2021). Selection guidelines for wind energy technologies. Energies, 14(11), 3244.
Mazzeo, D., Matera, N., De Luca, P., Baglivo, C., Congedo, P. M., & Oliveti, G. (2021). A literature review and statistical analysis of photovoltaic-wind hybrid renewable system research by considering the most relevant 550 articles: An upgradable matrix literature database. Journal of Cleaner Production, 295, 126070.
Ozturk, M., & Dincer, I. (2021). A comprehensive review on power-to-gas with hydrogen options for cleaner applications. International Journal of Hydrogen Energy, 46(62), 31511-31522.
Møller, K. T., Jensen, T. R., Akiba, E., & Li, H. W. (2017). Hydrogen-A sustainable energy carrier. Progress in Natural Science: Materials International, 27(1), 34-40.
Li, J., Liu, W., & Qi, W. (2021). Hydrogen production technology by electrolysis of water and its application in renewable energy consumption. In E3S Web of Conferences (Vol. 236, p. 02001). EDP Sciences.
Ezzahra Chakik, F., Kaddami, M., & Mikou, M. (2017). Effect of operating parameters on hydrogen production by electrolysis of water. international journal of hydrogen energy, 42(40), 25550-25557.
Chi, J., & Yu, H. (2018). Water electrolysis based on renewable energy for hydrogen production. Chinese Journal of Catalysis, 39(3), 390-394.
Wei, J., Zhou, M., Long, A., Xue, Y., Liao, H., Wei, C., & Xu, Z. J. (2018). Heterostructured electrocatalysts for hydrogen evolution reaction under alkaline conditions. Nano-micro letters, 10(4), 1-15.
Manzotti, A., Quattrocchi, E., Curcio, A., Kwok, S. C., Santarelli, M., & Ciucci, F. (2022). Membraneless electrolyzers for the production of low-cost, high-purity green hydrogen: A techno-economic analysis. Energy Conversion and Management, 254, 115156.
Esposito, D. V. (2017). Membraneless electrolyzers for low-cost hydrogen production in a renewable energy future. Joule, 1(4), 651-658.
Garimella, S., Vimal, A., Merugu, R., & Kumar, A. (2019). Optimization for enhanced hydrogen production from Rhodobacter sphaeroides using response surface methodology. SN Applied Sciences, 1(2), 1-8.
Chee, M. K., Ng, B. J., Chew, Y. H., Chang, W. S., & Chai, S. P. (2022). Photocatalytic Hydrogen Evolution from Artificial Seawater Splitting over Amorphous Carbon Nitride: Optimization and Process Parameters Study via Response Surface Modeling. Materials, 15(14), 4894.
Özgür, C., & Mert, M. E. (2022). Prediction and optimization of the process of generating green hydrogen by electrocatalysis: A study using response surface methodology. Fuel, 330, 125610.
Naseer, M. N., Zaidi, A. A., Khan, H., Kumar, S., Owais, M. T. B., Abdul Wahab, Y., & Alrobei, H. (2021). Statistical modeling and performance optimization of a two-chamber microbial fuel cell by response surface methodology. Catalysts, 11(10), 1202.
Palabras clave: Hidrógeno, Modelamiento, Electrolizador, Superficie de respuesta.
Abstract: In the present work, hydrogen production in a membrane-less electrolizer is modeled for KOH, NaCl and NaHCO3 solutions with different concentrations, using Responce Surface Methodology (RSM). It was found that the H2 flux can be explained as a function of the logarithm of the delivered power and the electrolyte concentration, with a fit better that 95% according to the linear regression models proposed from data obtained with a potentio-dynamic experimental desing for each type of electrolyte. In addition, a superior performance of 1M KOH was found, producing 22 cm3 standard per minute (sccm) at 18W.
Keywords: Hydrogen, Modeling, Electrolyzer, Response Surface.
1. INTRODUCCIÓN
La actual crisis medioambiental ha llevado a gobiernos y empresas a poner en marcha estrategias para mitigar el cambio climático, provocado por la emisión de gases de efecto invernadero derivados del uso de combustibles fósiles en todo el mundo
(Lamb et al., 2021)
. Una de las soluciones a este problema es la sustitución gradual de estos combustibles por sistemas descentralizados de energías renovables
individuales (solar fotovoltaica (FV) y eólica) (
A review of trends and drivers of greenhouse gas emissions by sector from 1990 to 2018. Environmental research letters, 16(7), 073005.
Victoria et al., 2021
;
Solar photovoltaics is ready to power a sustainable future. Joule, 5(5), 1041-1056.
Olabi et al., 2021
) o sistemas híbridos de energías renovables
Selection guidelines for wind energy technologies. Energies, 14(11), 3244.
(Mazzeo et al., 2021)
. En el caso de energías como la solar y la eólica, la luz y la energía cinética se convierten en energía eléctrica, que debe utilizarse
inmediatamente. Los sistemas Power-to-Gas
A literature review and statistical analysis of photovoltaic-wind hybrid renewable system research by considering the most relevant 550
articles: An upgradable matrix literature database. Journal of Cleaner Production, 295, 126070.
(Ozturk & Dincer, 2021)
en particular son de gran interés para resolver este problema, ya que permiten transformar la energía eléctrica en energía química en forma de
gas inflamable de forma similar al gas natural. Los combustibles son vectores energéticos, lo que hace posible transportar este recurso allí
donde se necesite y utilizarlo cuando sea necesario. El hidrógeno aparece en este punto como un vector energético
A comprehensive review on power-to-gas with hydrogen options for cleaner applications. International Journal of Hydrogen Energy, 46(62),
31511-31522.
(Møller et al., 2017)
para impulsar la implantación de las energías renovables, transformando la energía eléctrica que no se entrega inmediatamente a la red en
energía química en forma de hidrógeno gaseoso y oxígeno mediante la electrólisis del agua.Hydrogen-A sustainable energy carrier. Progress in Natural Science: Materials International, 27(1), 34-40.
El análisis energético del proceso de electrólisis puede evaluarse termodinámicamente utilizando el cambio de entalpía (ΔH) en la relación de la Ecuación (1).
\[ \Delta H = \Delta G + T \Delta S \hspace{1cm} (1)\]
Donde:
ΔG = Cambio en la energía libre de Gibbs
T = Temperatura
ΔS = Cambio de entropía
Considerando que ΔG es igual a -nEF, donde n es el número de cargas que intervienen en la reacción y F es la constante de Faraday, se puede calcular el potencial mínimo para la descomposición del agua (1.23V)
(Li et al., 2021)
y, en consecuencia, puede hallarse la cantidad mínima de energía necesaria para producir una determinada masa (o volumen) de hidrógeno, que en
condiciones estándar del agua sería de 120MJ/KgH2 (LHV), que es la densidad energética gravimétrica más alta en comparación con los
combustibles fósiles convencionales y las baterías de litio y plomo-ácido
Hydrogen production technology by electrolysis of water and its application in renewable energy consumption. In E3S Web of Conferences
(Vol. 236, p. 02001). EDP Sciences.
(Møller et al., 2017)
. Experimentalmente, se comprueba que el potencial de la celda necesario para llevar a cabo el proceso de electrólisis cambia obedeciendo a la
ecuación de Nernst y variables como el material del electrodo y la concentración del electrolito en el medio acuoso son importantes para
determinar el voltaje a aplicar. Además, el punto óptimo de generación de hidrógeno cambiará ya que la densidad de corriente J, además de
depender del sobrepotencial, también está ligada al tipo y cantidad de especies químicas en disolución
Hydrogen-A sustainable energy carrier. Progress in Natural Science: Materials International, 27(1), 34-40.
(Ezzahra et al., 2017)
. Este análisis energético requiere conocer la relación de la cantidad de hidrógeno producida a lo largo del tiempo (ccH2/t) con la potencia
suministrada (J/t), el tipo de electrolito utilizado y su concentración (M).
Effect of operating parameters on hydrogen production by electrolysis of water. International journal of hydrogen energy, 42(40),
25550-25557.
En la actualidad, destaca la investigación y posible uso industrial de la producción de hidrógeno con tres tipos de electrolito: líquido, membrana polimérica y membrana cerámica, las dos últimas son membranas sólidas de intercambio iónico específico (H+, OH-, O2-) que requieren principios de funcionamiento más complejos como altas temperaturas (80-1000°C), baja conductividad iónica a través de las membranas (OH-, O2-) y materiales caros (membranas y electrodos)
(Chi et al., 2018)
. La electrolisis en electrolito líquido alcalino sigue el principio funcional de las Reacciones de Evolución Hidrógeno y Oxígeno (HER y OER)
descritas en las Ecuaciones (2) y (3), en las que el ion encargado de transportar las cargas es el OH-.
Water electrolysis based on renewable energy for hydrogen production. Chinese Journal of Catalysis, 39(3), 390-394.
\[ 2H_2 O + 4e^- \rightarrow 4OH^- + 2H_2 \hspace{1cm} (2)\] \[ 4OH^- \rightarrow 2H_2O + O_2 + 4e^- \hspace{1cm} (3)\]
Típicamente, los materiales empleados para la fabricación de los electrodos utilizados en estos medios alcalinos son Ni, Co, Mo, Fe (aceros inoxidables) para el ánodo (
Chi et al., 2018
;
Water electrolysis based on renewable energy for hydrogen production. Chinese Journal of Catalysis, 39(3), 390-394.
Wei et al., 2018
) y aleaciones de Ni, Zn, Cu, Cr para el cátodo (
Heterostructured electrocatalysts for hydrogen evolution reaction under alkaline conditions. Nano-micro letters, 10(4), 1-15.
Ezzahra et al., 2017
;
Effect of operating parameters on hydrogen production by electrolysis of water. International journal of hydrogen energy, 42(40),
25550-25557.
Chi et al., 2018
), teniendo aplicaciones comerciales con eficiencias que pueden alcanzar el 70%; aunque los electrolizadores sin membrana tienen desventajas
como el medio altamente corrosivo y la pureza de los gases resultantes, las ventajas relacionadas con el coste de los materiales y el
mantenimiento, además de la simplicidad de los sistemas son experimentalmente llamativas (
Water electrolysis based on renewable energy for hydrogen production. Chinese Journal of Catalysis, 39(3), 390-394.
Manzotti et al., 2022
;
Membraneless electrolyzers for the production of low-cost, high-purity green hydrogen: A techno-economic analysis. Energy Conversion and
Management, 254, 115156.
Esposito, 2017
), en particular para la etapa de evaluación de la eficiencia energética y el rendimiento catalítico de los electrodos y su interacción en
diferentes medios acuosos.
Membraneless electrolyzers for low-cost hydrogen production in a renewable energy future. Joule, 1(4), 651-658.
Debido al gran interés de los procesos de producción de hidrógeno, es necesario modelar el comportamiento en función de las variables más influyentes según el caso. La superficie de respuesta es una metodología de modelamiento con gran éxito en ciencia e ingeniería, ampliamente utilizada en diseño de experimentos para la interpolación de datos mediante el resultado de regresiones lineales utilizando las dos variables más significativas del modelo. El resultado final tiene la forma de la Ecuación (4).
\[ Y = \beta_0 + \beta_1 X_1 + \beta_2 X_2 +\beta_3 X_1 X_2 \hspace{1cm} (4)\]
Donde:
Y= Variable dependiente
X1, X2 = Variables independientes
β0 = Intercepto
βn = Coeficientes de las variables independientes y sus interacciones
Para el caso de estudio, Y sería la cantidad de hidrógeno generada y X1, X2 son las variables independientes explicativas más influyentes en el proceso (
Garimella et al., 2019
;
Optimization for enhanced hydrogen production from Rhodobacter sphaeroides using response surface methodology. SN Applied Sciences, 1(2),
1-8.
Chee et al., 2022
;
Photocatalytic Hydrogen Evolution from Artificial Seawater Splitting over Amorphous Carbon Nitride: Optimization and Process Parameters
Study via Response Surface Modeling. Materials, 15(14), 4894.
Özgür & Mert, 2022
;
Prediction and optimization of the process of generating green hydrogen by electrocatalysis: A study using response surface methodology.
Fuel, 330, 125610.
Naseer et al., 2021
).
Statistical modeling and performance optimization of a two-chamber microbial fuel cell by response surface methodology. Catalysts, 11(10),
1202.
2. EXPERIMENTACIÓN
2.1 parámetros del electrolizador
Los experimentos fueron realizados en un electrolizador de electrolito líquido sin membrana, con cavidades individuales para cada electrodo con el fin de realizar una separación de los gases generados. Los materiales para el cátodo y el ánodo fueron cobre electrolítico y acero inoxidable SAE 316L respectivamente, ambos con un área de trabajo de 216cm2 (placas rectangulares de 13.5cm x 8cm sumergidos calibre 0.9mm) y separados 10cm uno del otro, como se evidencia en la Fig 1.
Fig. 1. Vista lateral del electrolizador.
2.2 Variables y diseño experimental
El proceso de modelamiento mediante el RSM se centra en un futuro análisis energético para determinar la eficiencia de un proceso de producción de hidrógeno. Para ello, fue necesario que una de las variables consideradas en la regresión estuviera relacionada con la potencia suministrada al sistema, es decir, QH2(P). Los experimentos se realizaron para 3 tipos diferentes de electrolito (KOH, NaCl, NaHCO3), cada uno con 4 concentraciones diferentes (0,25M, 0,5M, 0,75M y 1M). Se realizaron modelos independientes para cada tipo de electrolito. Dado que la concentración de los iones aumenta la densidad de corriente, ésta se consideró la segunda variable independiente para la superficie de respuesta y, de forma similar a la potencia, el flujo de hidrógeno también puede explicarse en función de la concentración QH2(c).El diseño experimental contempló un barrido de voltaje con saltos de 500mV/min, midiendo la corriente requerida por el electrolizador en un rango de potencia de 0-20W. Se consideraron los datos para los que había un flujo apreciable de gas a través del sensor (QH2 ≠ 0), como se ve en la Tabla 1. El voltaje y la corriente se relacionan con la potencia según la Ecuación 5.
\[ P = VI \hspace{1cm} (5)\]
Donde:
P = Potencia
V = Voltaje
I = Corriente
El hidrógeno se midió mediante el flujo de salida de la cavidad catódica del electrolizador, utilizando un sensor de flujo másico con principio de transferencia de calor, que no permitía correcciones por variaciones de temperatura y presión. Las unidades de lectura fueron en sccm, que, para el posterior análisis energético, permiten relacionar el caudal de hidrógeno producido (en g/min o cc/min en condiciones estándar) con la potencia aplicada (J/s).
Es importante destacar que las curvas obtenidas para cada concentración no tienen el mismo número de puntos, esto ocurre debido al mencionado aumento de la densidad de corriente en función del potencial aplicado, descrito por la ecuación de Butler-Volmer y el rango de potencias estudiado. El resultado final fue la obtención de datos para la modelización del flujo másico de hidrógeno en función de la potencia y de la concentración QH2 (P,c).
Tabla 1: Diseño experimental propuesto.
| Concentration (M) | Power (VxI) | Time (min) | |||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | … | t | |||
| 0.25 | P1 | Q1 | - | - | … | - | |
| P2 | - | Q2 | - | … | - | ||
| P3 | - | - | Q3 | … | - | ||
| … | … | … | … | … | - | ||
| Pi | - | - | - | - | Qi | ||
| 0.5 | P1 | Q1 | - | - | … | - | |
| P2 | - | Q2 | - | … | - | ||
| P3 | - | - | Q3 | … | - | ||
| … | … | … | … | … | - | ||
| Pj | - | - | - | - | Qj | ||
| 0.75 | P1 | Q1 | - | - | … | - | |
| P2 | - | Q2 | - | … | - | ||
| P3 | - | - | Q3 | … | - | ||
| … | … | … | … | … | - | ||
| Pk | - | - | - | - | Qk | ||
| 1 | P1 | Q1 | - | - | … | - | |
| P2 | - | Q2 | - | … | - | ||
| P3 | - | - | Q3 | … | - | ||
| … | … | … | … | … | - | ||
| Pl | - | - | - | - | Ql | ||
3. RESULTADOS Y DISCUSIÓN
3.1 Análisis de resultados
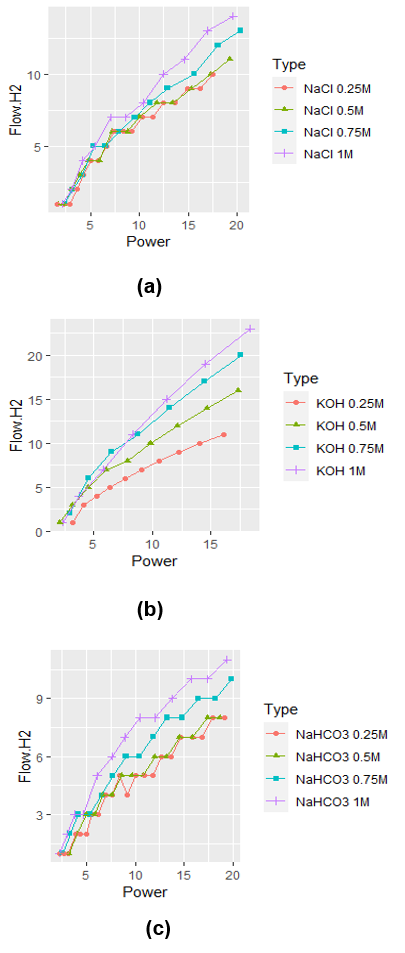
El comportamiento no lineal del flujo frente a la potencia ilustrado en la Fig. 2, muestra una primera aproximación a la relación masa-energía del electrolizador, donde se observa que a medida que aumenta la potencia, el flujo tiende a estabilizarse. Por ello, es correcto suponer que QH2(P) ~ ln(P) para los 3 tipos de electrolito. Del mismo modo, para la concentración, suponer que QH2(c) ~ ln(c) sería correcto para KOH, donde la diferencia entre flujos para el mismo valor de potencia se hace menor a medida que aumenta el valor de concentración. Sin embargo, observando dicho comportamiento para NaCl y NaHCO3, no habría pruebas suficientes para afirmar que esto es cierto. Por eso, a diferencia de la potencia, al tener sólo cuatro valores de concentración, es complejo determinar que esta suposición es válida a simple vista. Esta observación fue analizada en el modelo lineal, postulando que el flujo de hidrógeno podría ser modelado como se indica en la Ecuación (6).\[ Q_{(H_2)} = \beta_0 + \beta_1 \ln(P) + \beta_2 \ln(c) + \beta_3 \ln(P)\ln(c) \hspace{1cm} (6)\]

Fig. 2. Gráfico de datos de QH2 [sccm] Vs Potencia [W] para (a) KOH, (b)NaCl, (c) NaHCO3
Los rangos de voltaje aplicados fueron de 2-9,5V para KOH, 3-13,5V para NaCl y 5-17,5V para NaHCO3 y sus respectivos rangos de densidad de corriente de 2-14mA/cm2, 0,5-11mA/cm2 y 0,5-8mA/cm2. Se puede confirmar que la mayor cantidad de hidrógeno se produce empleando como electrolito una solución 1M de KOH, alcanzando una producción de 22sccm a 18W (~6V), seguido de NaCl con 18sccm a 20W (~8V) y finalmente NaHCO3 con 11sccm a 20W (~11.5V).
3.2 Análisis estadístico
En primer lugar, se realizó un ANOVA que mostró que al menos un par de medias en el conjunto de datos son significativamente diferentes entre sí para los tres tipos de electrolito, como se evidencia en la Tabla 2.Tabla 2: Resultados del análisis de varianza por tipo de electrolito.
| Electrolyte | Variable | Df | Sum Sq | Mean Sq | F value | P-value |
|---|---|---|---|---|---|---|
| KOH | ln(P) | 1 | 845.0 | 845.0 | 379.69 | < 2x10-16 |
| ln(c) | 1 | 154.1 | 154.1 | 69.25 | 2.74x10-9 | |
| Residuals | 30 | 66.8 | 2.2 | - | - | |
| NaCl | ln(P) | 1 | 611.9 | 611.9 | 813.99 | < 2x10-16 |
| ln(c) | 1 | 15.2 | 15.2 | 20.23 | 3.88x10-5 | |
| Residuals | 52 | 39.1 | 0.8 | - | - | |
| NaHCO3 | ln(P) | 1 | 390.7 | 390.7 | 888.36 | < 2x10-16 |
| ln(c) | 1 | 33.4 | 33.4 | 75.87 | 2.66x10-12 | |
| Residuals | 61 | 26.8 | 0.4 | - | - |
En los tres modelos lineales se incluyeron las variables involucradas en la Ecuación (6), acorde al comportamiento de los resultados experimentales. De acuerdo con el p-valor, para cada uno de los tratamientos y los interceptos de las regresiones existe significancia (valor-p < α) excepto para la variable ln(c) en el caso del NaHCO3. A pesar de ello, dado que el término de interacción es significativo, esta variable no puede excluirse del modelo.
Los coeficientes muestran que ln(P) tiene el mayor efecto sobre el flujo de gas para los 3 modelos y es superior para KOH como se observa en los resultados experimentales. Los efectos de ln(c) son menores, principalmente para NaCl y NaHCO3 donde el aumento de concentración evidencia diferencias de 1-4 sccm en contraste con KOH donde para el mismo valor de potencia hay diferencias de hasta 10 sccm.
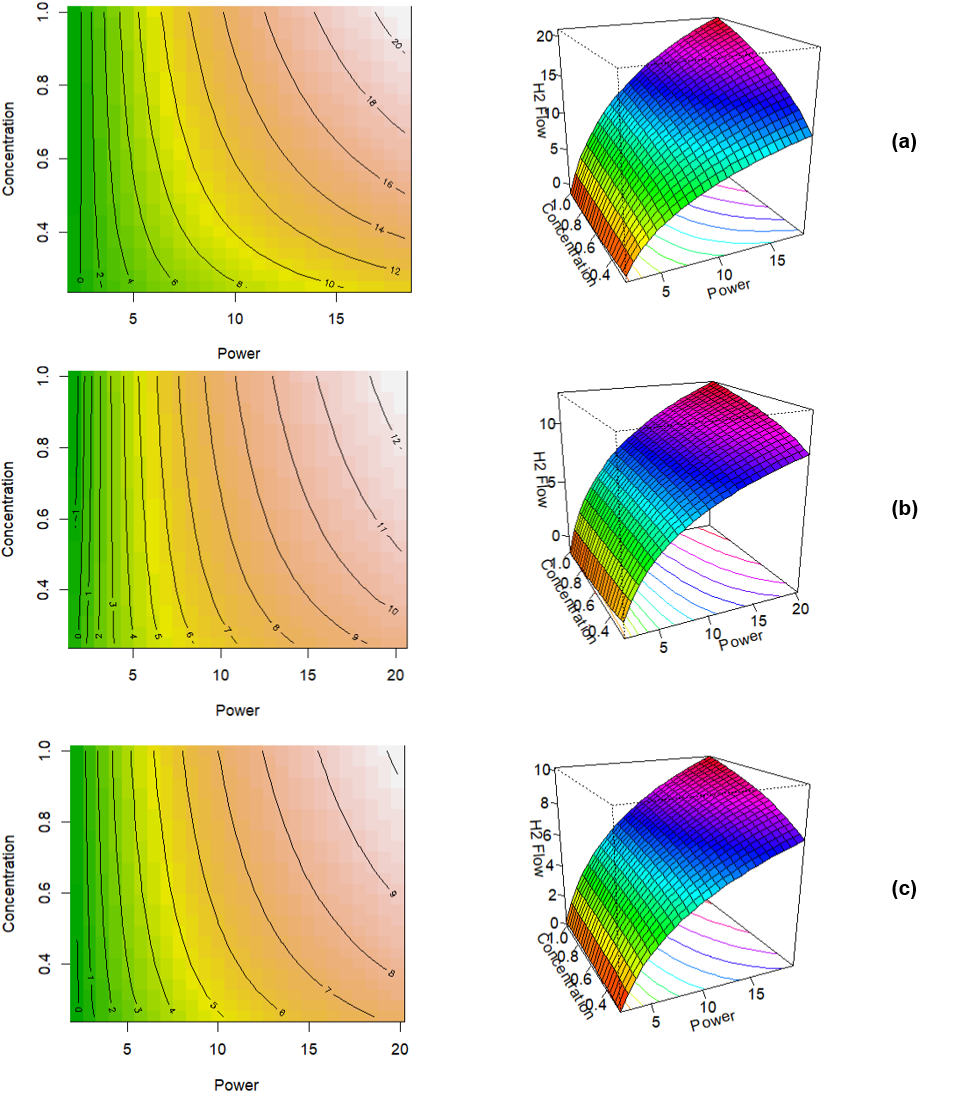
El término de interacción es significativo para los 3 modelos indicando que existe una fuerte dependencia entre la relación concentración-potencia y la producción de hidrógeno. Los modelos obtenidos se muestran en las Ecuaciones (6), (7) y (8), que obedecen a la forma de la Ecuación (4) propuesta inicialmente. Los modelos tienen ajustes de 0,97, 0,96 y 0,95 evidenciados en la Tabla 3, lo que indica una gran similitud con los resultados experimentales que pueden contrastarse con las superficies de respuesta de la Fig. 5.
\[ Q_{(H_2 KOH)}(P,c) = -9.05 + 10.28 \ln(P) - 3.17 \ln(c) + 3.54 \ln(P) \ln(c) \hspace{1cm} (7)\] \[ Q_{(H_2 NaCl)}(P,c) = -4.31 + 5.59 \ln(P) - 1.51 \ln(c) + 1.25 \ln(P) \ln(c) \hspace{1cm} (8)\] \[ Q_{(H_2 NaHCO_3)}(P,c) = -3.54 + 4.58 \ln(P) - 0.47 \ln(c) + 0.86 \ln(P) \ln(c) \hspace{1cm} (9)\]
Tabla3: Resultados de las regresiones lineales por tipo de electrolito.
| Electrolyte | Variable | Coeff. Est | Est. Error | t value | P-value | Multiple R2 | Adjusted R2 |
|---|---|---|---|---|---|---|---|
| KOH | Intercept | -9.05 | 0.90 | -10.00 | 6.47x10-11 | ||
| ln(P) | 10.28 | 0.42 | 24.20 | < 2x10-16 | |||
| Ln(c) | -3.17 | 1.20 | -2.65 | 0.01 | 0.97 | 0.97 | |
| ln(P)*ln(c) | 3.54 | 0.56 | 6.29 | 7.27x10-7 | |||
| NaCl | Intercept | -4.31 | 0.51 | -8.52 | 2.22x10-11 | ||
| ln(P) | 5.59 | 0.24 | 23.77 | < 2x10-16 | |||
| Ln(c) | -1.51 | 0.57 | -2.65 | 0.01 | 0.96 | 0.96 | |
| ln(P)*ln(c) | 1.25 | 0.27 | 4.63 | 2.57x10-5 | |||
| NaHCO3 | Intercept | -3.54 | 0.41 | -8.58 | 5.03x10-12 | ||
| ln(P) | 4.58 | 0.19 | 24.47 | < 2x10-16 | |||
| Ln(c) | -0.47 | 0.46 | -1.02 | 0.31 | 0.95 | 0.95 | |
| ln(P)*ln(c) | 0.86 | 0.21 | 4.07 | 1.39x10-4 |

Fig. 5. Gráficos de contorno y superficies de respuesta para (a) KOH, (b) NaCl, (c) NaHCO3, resultantes de los modelos ajustados
correspondientes a las Ecuaciones (6), (7) y (8). Las unidades de concentracion, potencia y flujo de hidrógeno están dadas en [M], [W] y
[sccm]
4. CONCLUSIONES
Los datos obtenidos a partir del diseño experimental propuesto permitieron postular una transformación logarítmica para los valores iniciales de potencia y concentración con el fin de obtener una relación lineal con respecto al flujo de hidrógeno. Estadísticamente, se confirmó que los modelos de regresión con dichas transformaciones se ajustan a los datos experimentales en un 97% para KOH, 96% para NaCl y 95% para NaHCO3, siendo una modelización fiable para un análisis de eficiencia energética.Los mayores flujos de hidrógeno se alcanzan utilizando soluciones 1M de cada electrolito; en primer lugar, KOH (22sccm a 18W) seguido de NaCl (18 sccm a 20W) y finalmente NaHCO3 (11sccm a 20W). Del mismo modo, el flujo aumenta al aumentar la potencia del electrolizador, de acuerdo con las ecuaciones (6), (7) y (8).
RECONOCIMIENTO
A la Universidad de Antioquia y al grupo de investigación TESLA.REFERENCIAS
Lamb, W. F., Wiedmann, T., Pongratz, J., Andrew, R., Crippa, M., Olivier, J. G., ... & Minx, J. (2021). A review of trends and drivers of greenhouse gas emissions by sector from 1990 to 2018. Environmental research letters, 16(7), 073005.Victoria, M., Haegel, N., Peters, I. M., Sinton, R., Jäger-Waldau, A., del Canizo, C., ... & Smets, A. (2021). Solar photovoltaics is ready to power a sustainable future. Joule, 5(5), 1041-1056.
Olabi, A. G., Wilberforce, T., Elsaid, K., Salameh, T., Sayed, E. T., Husain, K. S., & Abdelkareem, M. A. (2021). Selection guidelines for wind energy technologies. Energies, 14(11), 3244.
Mazzeo, D., Matera, N., De Luca, P., Baglivo, C., Congedo, P. M., & Oliveti, G. (2021). A literature review and statistical analysis of photovoltaic-wind hybrid renewable system research by considering the most relevant 550 articles: An upgradable matrix literature database. Journal of Cleaner Production, 295, 126070.
Ozturk, M., & Dincer, I. (2021). A comprehensive review on power-to-gas with hydrogen options for cleaner applications. International Journal of Hydrogen Energy, 46(62), 31511-31522.
Møller, K. T., Jensen, T. R., Akiba, E., & Li, H. W. (2017). Hydrogen-A sustainable energy carrier. Progress in Natural Science: Materials International, 27(1), 34-40.
Li, J., Liu, W., & Qi, W. (2021). Hydrogen production technology by electrolysis of water and its application in renewable energy consumption. In E3S Web of Conferences (Vol. 236, p. 02001). EDP Sciences.
Ezzahra Chakik, F., Kaddami, M., & Mikou, M. (2017). Effect of operating parameters on hydrogen production by electrolysis of water. international journal of hydrogen energy, 42(40), 25550-25557.
Chi, J., & Yu, H. (2018). Water electrolysis based on renewable energy for hydrogen production. Chinese Journal of Catalysis, 39(3), 390-394.
Wei, J., Zhou, M., Long, A., Xue, Y., Liao, H., Wei, C., & Xu, Z. J. (2018). Heterostructured electrocatalysts for hydrogen evolution reaction under alkaline conditions. Nano-micro letters, 10(4), 1-15.
Manzotti, A., Quattrocchi, E., Curcio, A., Kwok, S. C., Santarelli, M., & Ciucci, F. (2022). Membraneless electrolyzers for the production of low-cost, high-purity green hydrogen: A techno-economic analysis. Energy Conversion and Management, 254, 115156.
Esposito, D. V. (2017). Membraneless electrolyzers for low-cost hydrogen production in a renewable energy future. Joule, 1(4), 651-658.
Garimella, S., Vimal, A., Merugu, R., & Kumar, A. (2019). Optimization for enhanced hydrogen production from Rhodobacter sphaeroides using response surface methodology. SN Applied Sciences, 1(2), 1-8.
Chee, M. K., Ng, B. J., Chew, Y. H., Chang, W. S., & Chai, S. P. (2022). Photocatalytic Hydrogen Evolution from Artificial Seawater Splitting over Amorphous Carbon Nitride: Optimization and Process Parameters Study via Response Surface Modeling. Materials, 15(14), 4894.
Özgür, C., & Mert, M. E. (2022). Prediction and optimization of the process of generating green hydrogen by electrocatalysis: A study using response surface methodology. Fuel, 330, 125610.
Naseer, M. N., Zaidi, A. A., Khan, H., Kumar, S., Owais, M. T. B., Abdul Wahab, Y., & Alrobei, H. (2021). Statistical modeling and performance optimization of a two-chamber microbial fuel cell by response surface methodology. Catalysts, 11(10), 1202.